
����Ŀ������ѧ����ѡ��3�����ʽṹ�����ʡ�
Q��R��X��Y��ZΪ���ڱ�ǰ������Ԫ�أ�ԭ���������ε�������֪��
��QΪԪ�����ڱ���ԭ�Ӱ뾶��С��Ԫ�أ�
��R�Ļ�̬ԭ���е���ռ������������ͬ��ԭ�ӹ������ÿ�ֹ���еĵ���������ͬ��
��Y�Ļ�̬ԭ�ӵĺ���ɶԵ�������δ�ɶԵ�������3����
��Q��R��Y����Ԫ����ɵ�һ�ֻ�����M����װ�����г����е�һ���к����壬Q��R����Ԫ����ɵ�ԭ�Ӹ�����Ϊ1��1�Ļ�����N����ѧ��ѧ�г������л��ܼ���
��Z�������������֮�ƣ�Z4+���Ӻ��ԭ�ӵĺ�������Ų���ͬ��
��ش��������⣨����ʱ��Q��R��X��Y��Z������Ӧ��Ԫ�ط��ű�ʾ��
��1��������M�Ŀռ乹��Ϊ______________ ��������ԭ�Ӳ�ȡ_________�ӻ���������N�ڹ�̬ʱ�ľ�������Ϊ_______________��
��2��R��X��Y����Ԫ�صĵ�һ��������С�����˳��Ϊ___________��
��3��������һ�ֻ����Ԫ����ɵ���RY2��Ϊ�ȵ�����ķ���Ϊ__________��д����ʽ����
��4����R��X��Y����Ԫ����ɵ�RXY-���������������¿���NaClO��Һ��Ӧ������X2��RY2�����ʡ��÷�Ӧ�����ӷ���ʽΪ______________________________��
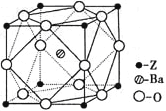
��5��Zԭ�ӻ�̬ʱ����Χ�����Ų�ʽΪ_________________��Z��һ�ֺ����ᱵ�εľ����ṹ��ͼ��ʾ����������ÿ��Zԭ�ӵȾ������������ԭ����Ϊ____________��
���𰸡� ƽ�������� sp2 ���Ӿ��� C<O<N N2O 2CNO![]() +2H
+2H![]() +3ClO
+3ClO![]() = N2��+2CO2��+3C1
= N2��+2CO2��+3C1![]() +H2O 3d24s2 6
+H2O 3d24s2 6
��������������Ҫ����ԭ�ӽṹ�ȡ�
���ж�Q��R��X��Y��Z�ֱ����⡢̼�����������ѡ�
��1��������M�Ǽ�ȩ�����Ŀռ乹��Ϊƽ�������Σ�������ԭ�Ӳ�ȡsp2�ӻ���������N�DZ����ڹ�̬ʱ�ľ�������Ϊ���Ӿ�����
��2��һ��ǽ�����Խǿ����һ������Խ�ǽ����ԣ�C<N<O���������ڵ�ԭ���������Ӵ��ڰ�����Ľ��ȶ�״̬��ʹ�õ��ĵ�һ�����ܴ�����������R��X��Y����Ԫ�صĵ�һ��������С�����˳��ΪC<O<N��
��3��RY2��CO2��������һ�ֻ����Ԫ����ɵ���RY2��Ϊ�ȵ�����ķ���ΪN2O��
��4����R��X��Y����Ԫ����ɵ�RXY-���������������¿���NaClO��Һ��Ӧ������X2��RY2�����ʡ��÷�Ӧ�����ӷ���ʽΪ2CNO![]() +2H
+2H![]() +3ClO
+3ClO![]() = N2��+2CO2��+3C1
= N2��+2CO2��+3C1![]() +H2O��
+H2O��
��5��Zԭ�ӻ�̬ʱ����Χ�����Ų�ʽΪ3d24s2��Z��һ�־�������ÿ��Zԭ�ӵȾ������������ԭ�Ӵ�����������Ķ��㣬���Ը���ԭ����Ϊ6��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪NO������ˮ��NO2������ˮ������ˮ������Ӧ3NO2+H2O�T2HNO3+NO����48mL NO��NO2������������������ˮ�У�����ͬ��ͬѹ������Һ���ȶ�������������������Ϊ24 mL����
��1��ԭ������У�NO��mL��NO2��mL��
��2������ʣ���24mL�����У�ͨ��6mL O2 �� ��Һ���ȶ���Ӧ��������ʣ���������ΪmL��
��3������ʣ���24mL�����У�ͨ��24mL O2 �� ��Һ���ȶ���Ӧ��������ʣ���������ΪmL��
��4������ԭ48mL NO��NO2�У�ͨ��mL O2�ٵ�����ˮ�У������ȫ�������գ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Һ���ζ�NaOH����Һ�����в������ܻ�ʹ�ⶨ���ƫ�͵���
A.��ʽ�ζ���ֻ��ˮϴB.��ƿֻ��ˮϴ
C.��һ�ι۲���ʽ�ζ��ܵĿ̶�ʱ����D.�ζ��ܵζ���ʼǰ�����ݣ��ζ�����ʧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���淴Ӧ��M��g����N��g��![]() P��g����Q��g������H>0����ش��������⣺
P��g����Q��g������H>0����ش��������⣺
��1����ij�¶��£���Ӧ�����ʼŨ�ȷֱ�Ϊc��M����1 mol��L��1��c��N����2.4 mol��L��1���ﵽƽ���M��ת����Ϊ60%����ʱN��ת����Ϊ________�����¶�ʱ��ƽ�ⳣ��K��________��
��2������Ӧ�¶����ߣ���M��ת����________����������������С����������������
��3������Ӧ�¶Ȳ��䣬��Ӧ�����ʼŨ�ȷֱ�Ϊc��M����4 mol��L��1��c��N����a mol��L��1���ﵽƽ���c��P����2 mol��L��1����a��________��
��4������Ӧ�¶Ȳ��䣬��Ӧ�����ʼŨ��Ϊc��M����c��N����b mol��L��1���ﵽƽ���M��ת����Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.ú�ĸ����ʯ���ѽ�õ��IJ�����ͬ
B.2-������Ҳ��Ϊ�춡��
C.C3H4��C4H6����һ����Ϊͬϵ��
D.������л����Ƿǵ���ʣ������硢�۵��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ż�ʱ���������������� ( )
A. ʪ�� B. �ɷ������(��Ҫ�ɷ֣�CO2) C. ú�� D. ɳ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����-50��ʱ��Һ���ĵ����ˮ�ĵ������ƣ�����ƽ�⣺2NH3(l)![]() NH4++NH2-��NH4+��ƽ��Ũ��Ϊ1��10-15mol��L-1������˵���������
NH4++NH2-��NH4+��ƽ��Ũ��Ϊ1��10-15mol��L-1������˵���������
A. ��Һ���м���NaNH2����ʹҺ�������ӻ����
B. ���¶���Һ�������ӻ�KΪ1��10-30
C. ��Һ���м���NH4Cl��Һ�������ӻ�����
D. �ı��¶ȣ�Һ����c(NH4+)=c(NH2-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ�д��ڵ���ƽ��CH3COOH![]() H++CH3COO-��������������ȷ����
H++CH3COO-��������������ȷ����
A. �����¶ȣ�ƽ�������ƶ�������ĵ��볣��Kaֵ����
B. 0.l0mol/L��CH3COOH��Һ�м�ˮϡ�ͣ���Һ��c(OH-)����
C. CH3COOH��Һ�м�������CH3COONa���壬ƽ�������ƶ�
D. �����£���ʹ0.1mol/L������Һ��pH�������a����С���ɼ�������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ӧ���������ˮ���ص��ǣ� ��
A. ������Һ��ȥ������ B. FeCl3������Һ�����ˮ����Fe(OH)3����
C. ��ĭ����������ԭ�� D. NaCl�������������͵�ζ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com