
����Ŀ����֪���淴Ӧ��M��g����N��g��![]() P��g����Q��g������H>0����ش��������⣺
P��g����Q��g������H>0����ش��������⣺
��1����ij�¶��£���Ӧ�����ʼŨ�ȷֱ�Ϊc��M����1 mol��L��1��c��N����2.4 mol��L��1���ﵽƽ���M��ת����Ϊ60%����ʱN��ת����Ϊ________�����¶�ʱ��ƽ�ⳣ��K��________��
��2������Ӧ�¶����ߣ���M��ת����________����������������С����������������
��3������Ӧ�¶Ȳ��䣬��Ӧ�����ʼŨ�ȷֱ�Ϊc��M����4 mol��L��1��c��N����a mol��L��1���ﵽƽ���c��P����2 mol��L��1����a��________��
��4������Ӧ�¶Ȳ��䣬��Ӧ�����ʼŨ��Ϊc��M����c��N����b mol��L��1���ﵽƽ���M��ת����Ϊ________��
���𰸡� 25% 0.5 ���� 6 41%
��������������Ҫ�������ƽ�ⳣ���ļ��㡣
��1��ƽ��Ũ�ȣ�c��M����0.4mol��L��1��c��N����1.8mol��L��1��c��P����0.6mol��L��1��c��Q����0.6mol��L��1����ʱN��ת����Ϊ0.6/2.4=25%�����¶�ʱ��ƽ�ⳣ��K��c��P��c��Q��/[c��M��c��N��]=0.5��
��2������Ӧ�¶����ߣ�ƽ�����ƣ���M��ת��������
��3������Ӧ�¶Ȳ��䣬K��22/(4-2)(a-2)=0.5,��a��6��
��4������Ӧ�¶Ȳ��䣬��Mת��cmol/L��K��c2/(b-c)2=0.5��2.41c=b��M��ת����Ϊc/2.41c=41%��


 ���ݼ���ϵ�д�
���ݼ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ����٤��������ֵ��������NA�йص�˵����ȷ����
A. 12g���ʯ�к��еĹ��ۼ���Ϊ4NA
B. S2��S8�Ļ���ﹲ64 g������������ԭ��������Ϊ2NA
C. 60gSiO2�����к���Si-O����ĿΪ2NA
D. 44g�ɱ�����( )���е�CO2���Ӹ���Ϊ14NA
)���е�CO2���Ӹ���Ϊ14NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д����ȷ����( )
A. ̼��������ᷴӦ�� CaCO3��2H��===CO2����H2O+ Ca2��
B. ���������������Һ��Ӧ�� 2OH- + Ba2����2H++SO![]() ===BaSO4����2H2O
===BaSO4����2H2O
C. ������������ͭ��Һ�У� 2Fe��3Cu2��===2Fe3����3Cu
D. ����ˮ��Ӧ�� 2Na��2H2O ===2Na����2OH����H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ����ѡ��5���л���ѧ������
��A�ķ�����Ϊ92������̼ԭ�Ӷ���ͬһƽ���ϡ�һ������A�Ʊ�ˮ����Ĺ�������:
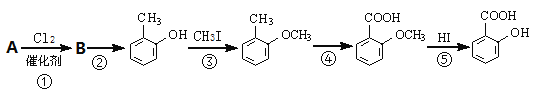
��1����д����A����B�ķ�Ӧ����ʽ��_____________________________________________��
��2���ںϳ���·�У���Ƶڢۺ͵ڢ���������Ӧ��Ŀ���� ��__________________________��
��3������ˮ������ص�ת����ϵ���£�
 ��д�����з�Ӧ����ʽ
��д�����з�Ӧ����ʽ
��ˮ��������D�Ļ�ѧ��Ӧ����ʽ��_________________________________��
�ٴ�������Ӧ�Ļ�ѧ����ʽ��______________________________________��
�ݴ�������Ӧ�Ļ�ѧ����ʽ��________________________________��
�÷�Ӧ����Ϊ��__________��
��4����д��ͬʱ��������Ҫ���ˮ���������ͬ���칹��Ľṹ��ʽ��_________________��
�ٵ���FeCl3 ��Һ�����Һ����ɫ
���ܷ���������Ӧ�����ܷ���ˮ�ⷴӦ
�۱�����һ�ȴ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ֪ʶ��գ�
��1��ʵ�����п���KClO3��ŨHCl��Ӧ��ȡ������д���÷�Ӧ�Ļ�ѧ����ʽ������˫���ŷ��������ת�Ƶķ������Ŀ���÷�Ӧ�У����������� �� ��ԭ������ �� ���������뻹ԭ��������ʵ���֮���� ��
��2����ѧ��������Һ�к���Ni2+��H2PO2�������������·������·�Ӧ������ƽ�÷�Ӧ��
Ni2++H2PO2��+�� Ni++H2PO3��+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯�����������仯����
A.�����γ�Һ��B.ú������C.ʯ�͵ķ���D.��ɫ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ����ѡ��3�����ʽṹ�����ʡ�
Q��R��X��Y��ZΪ���ڱ�ǰ������Ԫ�أ�ԭ���������ε�������֪��
��QΪԪ�����ڱ���ԭ�Ӱ뾶��С��Ԫ�أ�
��R�Ļ�̬ԭ���е���ռ������������ͬ��ԭ�ӹ������ÿ�ֹ���еĵ���������ͬ��
��Y�Ļ�̬ԭ�ӵĺ���ɶԵ�������δ�ɶԵ�������3����
��Q��R��Y����Ԫ����ɵ�һ�ֻ�����M����װ�����г����е�һ���к����壬Q��R����Ԫ����ɵ�ԭ�Ӹ�����Ϊ1��1�Ļ�����N����ѧ��ѧ�г������л��ܼ���
��Z�������������֮�ƣ�Z4+���Ӻ��ԭ�ӵĺ�������Ų���ͬ��
��ش��������⣨����ʱ��Q��R��X��Y��Z������Ӧ��Ԫ�ط��ű�ʾ��
��1��������M�Ŀռ乹��Ϊ______________ ��������ԭ�Ӳ�ȡ_________�ӻ���������N�ڹ�̬ʱ�ľ�������Ϊ_______________��
��2��R��X��Y����Ԫ�صĵ�һ��������С�����˳��Ϊ___________��
��3��������һ�ֻ����Ԫ����ɵ���RY2��Ϊ�ȵ�����ķ���Ϊ__________��д����ʽ����
��4����R��X��Y����Ԫ����ɵ�RXY-���������������¿���NaClO��Һ��Ӧ������X2��RY2�����ʡ��÷�Ӧ�����ӷ���ʽΪ______________________________��
��5��Zԭ�ӻ�̬ʱ����Χ�����Ų�ʽΪ_________________��Z��һ�ֺ����ᱵ�εľ����ṹ��ͼ��ʾ����������ÿ��Zԭ�ӵȾ������������ԭ����Ϊ____________��
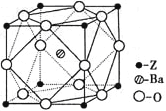
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
�����仯�����ڿ�ѧ�о��к�ҵ�����о���������;��
��1����̬��ԭ�ӵĺ���۵����Ų�ʽΪ________��
��2������+2��+3��+4��+5�ȼ��ֻ��ϼۡ��⼸�ּ�̬�У����ȶ�����______��
��3��V2O5�ܽ���NaOH��Һ�У��ɵõ������ƣ�Na3VO4����������VO43-�ռ乹����ͬ��һ��������__________���ѧʽ����
��4����������������[V��CN��6]4-��[V��H2O��6]2+�ȡ�
��CN-��N2��Ϊ�ȵ����壬CN-��������������Ŀ��Ϊ________��
�ڶ�H2O��V2+�γ�[V��H2O��6]2+���̵���������������______________��
a.��ԭ�ӵ��ӻ����ͷ����˱仯
b.���Ļ�ѧ���ʷ����˸ı�
c.������������H��O���ļнǷ����˸ı䡣
d.H2O��V2+֮��ͨ�����»������ϡ�
����[V��H2O��6]2+�д��ڵĻ�ѧ����___________��
a.������ b.��� c. ���� d.���� f. ���
��5����֪���ʷ��ľ�����ͼ����Vԭ�ӵ���λ����_______�����辧���ı߳�Ϊd nm���ܶ��� g��cm-3�������ԭ������Ϊ_______________�����谢��٤������ΪNA��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
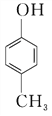
����Ŀ�����ǻ�����ȩ���׳�PHBA����һ����Ҫ���л�����ԭ�ϡ���ṹΪ![]() ������������ԶԼ�����Ϊԭ�Ϻϳ�PHBA��;�����£�
������������ԶԼ�����Ϊԭ�Ϻϳ�PHBA��;�����£�
![]() CH3OCH3
CH3OCH3
![]() C
C
![]() D
D![]() E
E![]() PHBA
PHBA
��֪��![]()
(1)PHBA�Ĺ����ŵ�����Ϊ________��
(2)�����й�PHBA��˵����ȷ����________��
A��PHBA�ķ���ʽΪC7H6O2
B��PHBA��һ�ַ�����
C��1 mol PHBA�������4 mol H2��Ӧ
D��PHBA����NaHCO3��Һ��Ӧ����CO2
(3)������Ӧ������ȡ����Ӧ����________��
(4)��Ӧ�۵Ļ�ѧ����ʽΪ____________________________��
(5)�úϳ�;���еķ�Ӧ�٢ݵ�����Ϊ_________________��
(6)E�ж���ͬ���칹�壬������������������ͬ���칹��Ľṹ��ʽΪ__________________(ֻдһ��)��
a�������ϴ���2�ֲ�ͬ��ѧ��������ԭ�ӣ��Ҹ�����Ϊ1��2
b����FeCl3��Һ��ʾ������ɫ
c����ʹ������Ȼ�̼��Һ��ɫ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com