
【题目】根据所学知识填空:
(1)实验室中可用KClO3和浓HCl反应制取氯气,写出该反应的化学方程式,并用双线桥法标出电子转移的方向和数目;该反应中,氧化产物是 , 还原产物是 , 氧化产物与还原产物的物质的量之比是 .
(2)化学镀镍的溶液中含有Ni2+和H2PO2﹣在酸性条件下发生如下反应,请配平该反应.
Ni2++H2PO2﹣+→ Ni++H2PO3﹣+
【答案】
(1)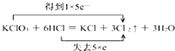 ;Cl2;Cl2;5:1
;Cl2;Cl2;5:1
(2)2;1;H2O;2;1;2H+
【解析】解::(1)反应中KClO3+6HCl=KCl+3Cl2↑+3H2O中,只有Cl元素化合价发生变化,当有3mol Cl2生成时,转移5mol电子,则电子转移的方向和数目为 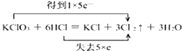 ,该反应中,氧化产物和还原产物都是Cl2 , 其中氧化产物与还原产物的物质的量之比是5:1,所以答案是:
,该反应中,氧化产物和还原产物都是Cl2 , 其中氧化产物与还原产物的物质的量之比是5:1,所以答案是: 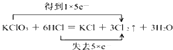 ;Cl2;Cl2;5:1;(2)观察反应式可知镍从+2价变成+1价,化合价降了1,H2PO2﹣中的P为+1价变为H2PO3﹣中的P+3价,化合价升了2,据得失电子总数相等的原则,在镍前需配上系数2,H2PO2﹣前需配上系数1.再据原子个数守恒可知,左边反应物只有两个氧,而右边有三个,因此在反应物中肯定还有一个氧原子,而题目中说,该反应时在酸性条件下进行,所以反应物中应该是水参与了反应,所以可以得出2Ni2++H2PO2﹣+H2O=2Ni++H2PO3﹣+2H+ , 所以答案是:2Ni2++H2PO2﹣+H2O=2Ni++H2PO3﹣+2H+ .
;Cl2;Cl2;5:1;(2)观察反应式可知镍从+2价变成+1价,化合价降了1,H2PO2﹣中的P为+1价变为H2PO3﹣中的P+3价,化合价升了2,据得失电子总数相等的原则,在镍前需配上系数2,H2PO2﹣前需配上系数1.再据原子个数守恒可知,左边反应物只有两个氧,而右边有三个,因此在反应物中肯定还有一个氧原子,而题目中说,该反应时在酸性条件下进行,所以反应物中应该是水参与了反应,所以可以得出2Ni2++H2PO2﹣+H2O=2Ni++H2PO3﹣+2H+ , 所以答案是:2Ni2++H2PO2﹣+H2O=2Ni++H2PO3﹣+2H+ .


科目:高中化学 来源: 题型:
【题目】已知X,Y,Z,W(含同一元素)有如转化关系,若X是一种单质,W为一种含氧酸,则X不可能是( )
X ![]() Y
Y ![]() Z
Z ![]() W.
W.
A.N2
B.C
C.S
D.Si
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应式:⑴2Fe3+ + 2I- = 2Fe2+ + I2 ⑵Br2 + 2Fe2+ = 2Br- + 2Fe3+可判断离子的还原性由强到弱的顺序是( )
A. Br-、Fe2+、I- B. Br-、I-、Fe2+ C. I-、Fe2+、Br- D. Fe2+、I-、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用盐酸标准液来滴定NaOH待测液,下列操作可能会使测定结果偏低的是
A.酸式滴定管只用水洗B.锥形瓶只用水洗
C.第一次观察酸式滴定管的刻度时仰视D.滴定管滴定开始前有气泡,滴定后消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在其他条件不变的情况下,升高温度,下列数值不一定增大的是( )
①水解平衡常数 ②化学平衡常数 ③电离平衡常数 ④物质的溶解度
A.②③B.①④C.③④D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可逆反应:M(g)+N(g)![]() P(g)+Q(g) ΔH>0。请回答下列问题:
P(g)+Q(g) ΔH>0。请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为c(M)=1 mol·L-1,c(N)=2.4 mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为________;该温度时的平衡常数K=________。
(2)若反应温度升高,则M的转化率________(填“增大”“减小”或“不变”)。
(3)若反应温度不变,反应物的起始浓度分别为c(M)=4 mol·L-1,c(N)=a mol·L-1,达到平衡后,c(P)=2 mol·L-1,则a=________。
(4)若反应温度不变,反应物的起始浓度为c(M)=c(N)=b mol·L-1,达到平衡后,M的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.煤的干馏和石油裂解得到的产物相同
B.2-甲基丁烷也称为异丁烷
C.C3H4和C4H6两者一定互为同系物
D.大多数有机物是非电解质,不易导电、熔点低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在-50℃时,液氨的电离跟水的电离相似,存在平衡:2NH3(l)![]() NH4++NH2-,NH4+的平衡浓度为1×10-15mol·L-1,下列说法错误的是
NH4++NH2-,NH4+的平衡浓度为1×10-15mol·L-1,下列说法错误的是
A. 在液氨中加入NaNH2,可使液氨的离子积变大
B. 此温度下液氨的离子积K为1×10-30
C. 在液氨中加入NH4Cl,液氨的离子积不变
D. 改变温度,液氨中c(NH4+)=c(NH2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物对人类的生产和生活有着重要的作用。一种由含硫化合物参与的制氢示意图如下:

(1)①反应2的化学方程式为___________;该反应能量转化的主要方式为_________。
②反应4的热化学方程式为2H2SO4(l)![]() 2SO2(g)+O2(g)+2H2O(g) △H=+550kJ/mol
2SO2(g)+O2(g)+2H2O(g) △H=+550kJ/mol
已知:a. H2SO4(l)![]() SO3(g)+H2O(g) △H=X
SO3(g)+H2O(g) △H=X
b.2SO3(g)![]() 2SO2(g)+O2(g) △H=+196kJ/mol
2SO2(g)+O2(g) △H=+196kJ/mol
则X=____________。
(2)SO2是一种大气污染物,已知: 2SO2(g)+O2(g)![]() 2SO3(g) △H<0。
2SO3(g) △H<0。
①下列有关该反应速率的叙述正确的是_____________(填字母)。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强能增大活化分子百分数,加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
②该反应的化学平衡常数表达式为K=____________。
③下列有关图像一定正确的是__________(填字母)。

(3)现有甲、乙两个体积相等的恒容容器,甲容器中充入1molSO2和1molO2,乙容器中充入1molSO3和0.5molO2,发生反应:2SO2(g)+O2(g)![]() 2SO3(g) △H<0,甲、乙容器起始反应温度相同,两容器均为绝热容器,平衡时,甲容器中SO2的转化率为a,乙容器中SO3的分解率为b,则:
2SO3(g) △H<0,甲、乙容器起始反应温度相同,两容器均为绝热容器,平衡时,甲容器中SO2的转化率为a,乙容器中SO3的分解率为b,则:
①a+b__________1(填“<”、“>”或“=”)。
②下列叙述能说明甲容器中反应达平衡状态的是_______________(填字母)。
A.v正(O2)=2v逆(SO3) B.混合气体的密度不变
C.c(SO2)=c(SO3) D.混合气体的总物质的量不变
E.容器内温度不变 F.SO2和O2的质量比不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com