
【题目】叠氮化钠(NaN3)是制备医药、炸药的一种重要原料,NaN3易溶于水,微溶于乙醇,易溶于乙醚,水溶液中遇酸放出有毒的HN3;工业上采用“亚硝酸甲酯——水合肼法”制备叠氮化钠的生产流程如图:
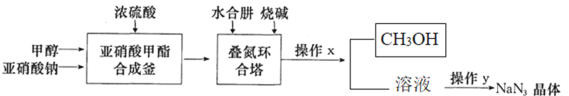
回答下列问题:
(1)写出亚硝酸甲酯合成釜中生成CH3ONO的化学反应方程式:______。
(2)亚硝酸甲酯以气体进入叠氮环合塔中生成叠氮化钠的反应方程式为______。
(3)水合肼(N2H4·H2O)的性质类似一水合氨,与硫酸反应可以生成酸式盐,该盐的化学式为______;叠氮环合塔中滴加的烧碱溶液要适当过量,目的是_____;生产流程中操作x的名称是______。
(4)操作y对溶液加热蒸发至溶液体积的![]() ,有NaN3晶体析出,洗涤晶体可以用___。
,有NaN3晶体析出,洗涤晶体可以用___。
A.水 B.乙醇 C.乙醇水溶液 D.乙醚
该生产过程中可循环使用的物质是_______。
(5)生产中有HN3生成,请设计实验证明HN3为弱酸:_______。
(6)化工生产中,多余的NaN3常使用次氯酸钠溶液处理,在酸性条件下,二者反应可生成无毒的气体。若处理6.5 g NaN3,理论上需加入0.5 mol·L-1的NaClO溶液_____mL。
【答案】2CH3OH+2NaNO2+H2SO4=2CH3ONO+Na2SO4+2H2O N2H4+CH3ONO+NaOH=NaN3+CH3OH+2H2O (N2H6)(HSO4)2 提高亚硝酸甲酯和水合肼的转化率,抑制叠氮化钠水解 蒸馏 C 甲醇 使用pH试纸测定NaN3溶液的酸碱性,若该溶液显碱性,说明HN3为弱酸(也可采用其他方法,如测定0.1 mol/L HN3的pH,若pH大于1,说明HN3为弱酸) 100
【解析】
NaNO2与甲醇、浓硫酸反应得到CH3ONO,加入NaOH、水合肼溶液反应:CH3ONO+N2H4H2O+NaOH=CH3OH+NaN3+3H2O,得到NaN3,加热、浓缩,加入浓硫酸,得到(N2H6)(HSO4)2,加入氢氧化钠,蒸馏将甲醇分离,然后通过结晶、抽滤、洗涤、干燥得到产品,以此解答该题。
(1)根据装置图可知:亚硝酸甲酯合成釜有三种原料:浓硫酸、甲醇和亚硝酸钠,浓硫酸可以酸化亚硝酸钠,并为酯化反应提供催化剂,得到甲醇的无机酸酯和水,反应方程式为:2CH3OH+2NaNO2+H2SO4=2CH3ONO+Na2SO4+2H2O;
(2)叠氮环合塔中加入了水合肼与烧碱,烧碱可以使第一步得到的亚硝酸甲酯水解,产生甲醇和亚硝酸钠,同时亚硝酸钠和肼里的氮元素发生归中反应得到产物叠氮化钠,反应方程式为N2H4+CH3ONO+NaOH=NaN3+CH3OH+2H2O;
(3)水合肼的性质类似一水合氨,在水中应该能电离产生N2H62+和OH-,因此它的硫酸酸式盐的化学式为(N2H6)(HSO4)2;叠氮环合塔中适当滴加过量的烧碱有两个作用:一方面可以提高亚硝酸甲酯和水合肼的转化率;另一方面可以抑制叠氮化钠这个强碱弱酸盐的水解;在反应后的溶液中含有NaN3、CH3OH、过量的NaOH及在合成釜中产生Na2SO4;NaN3、NaOH、Na2SO4都是离子化合物,熔沸点高,而CH3OH是由分子构成的物质,熔沸点比较低,易气化,分离互溶的沸点不同的液体混合物,可通过蒸馏方法分离得到,沸点低的甲醇CH3OH变为蒸气逸出,通过冷凝进行收集,在剩余溶液中含有Na2SO4和NaN3、NaOH;
(4)操作y是对溶液加热蒸发至溶液体积的![]() ,有NaN3晶体析出,由于NaN3易溶于水,微溶于乙醇,易溶于乙醚,而杂质Na2SO4和NaOH易溶于水,为减少洗涤中NaN3的损失,同时要尽可能多的溶解杂质,应该选择乙醇水溶液洗涤NaN3晶体,故合理选项是C;
,有NaN3晶体析出,由于NaN3易溶于水,微溶于乙醇,易溶于乙醚,而杂质Na2SO4和NaOH易溶于水,为减少洗涤中NaN3的损失,同时要尽可能多的溶解杂质,应该选择乙醇水溶液洗涤NaN3晶体,故合理选项是C;
由于在亚硝酸甲酯合成釜里甲醇反应形成了酯,在叠氮环合塔中酯又水解产生甲醇,因此整个过程中甲醇是可以循环利用的,故该生产过程中可循环使用的物质是甲醇;
(5)若要证明HN3为弱酸,可以用pH试纸来检测NaN3溶液的pH,根据盐的水解规律:“有弱就水解,谁弱谁水解,谁强显谁性”的规则,若溶液显碱性,则证明HN3为弱酸,其它合理的方法也可以,如测定0.1 mol/L HN3的pH,若pH大于1,说明HN3为弱酸;
(6)根据描述,NaN3应该被氧化为无毒的N2,同时ClO-被还原为Cl-,因此每个NaN3在反应中失去1个电子,每个ClO-在反应中可得到2个电子,因此二者反应的物质的量之比为2:1;NaN3的物质的量n(NaN3)=![]() =0.1 mol,则需要ClO-的物质的量n(NaClO)=
=0.1 mol,则需要ClO-的物质的量n(NaClO)=![]() n(NaN3)=
n(NaN3)=![]() ×0.1 mol=0.05 mol,因此需要次氯酸钠溶液体积V=
×0.1 mol=0.05 mol,因此需要次氯酸钠溶液体积V=![]() =0.1 L=100 mL。
=0.1 L=100 mL。


科目:高中化学 来源: 题型:
【题目】常温常压下,某烃和氧气的混合气体4L,点燃后恰好完全燃烧,通过浓硫酸后恢复到原来状态,体积变为2L。则符合题意的某烃为( )
A.C4H8B.C3H8C.C2H2D.CH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常情况下,NCl3是一种油状液体,其分子空间构型与NH3相似,下列对NCl3和NH3的有关叙述正确的是( )
A. 分子中N—Cl键键长与CCl4分子中C—Cl键键长相等
B. NCl3分子是非极性分子
C. NBr3比NCl3易挥发
D. 在氨水中,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子,则NH3·H2O的结构式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新春佳节少不了饮酒,土法酿造葡萄酒(只加糖的纯天然酿酒法)容易出问题,有报道说,喝了自制葡萄酒差点失明。主要原因是发酵过程产生的菌种多达百种,难以控制,而产生对神经有毒的甲醇等物质。科学酿酒须加SO2等辅料。我国国家标准(GB2760-2014)规定葡萄酒中SO2的残留量≤0.25g/L。
(1)葡萄酒中添加SO2的作用可能是________。
A.抗氧化 B. 氧化细菌 C.增酸作用 D. 漂白
I.实验方案一
利用SO2的漂白性检测干白葡萄酒(液体为无色)中的SO2或H2SO3。设计如图的实验:
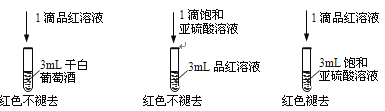
(2)甲同学得出实验结论: 干白葡萄酒中不含SO2或H2SO3。这个结论是否合理?说明理由___________。
Ⅱ.实验方案二
如图是在实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。
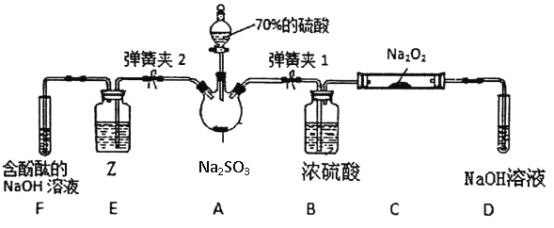
(3)关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没瓶中固体,写出A装置反应的化学方程式______,C中每消耗2molNa2O2,则转移电子数___________。
(4)关闭弹簧夹1后,打开弹簧夹2,残余气体进入E、F中,为了证明SO2有还原性,并从绿色化学的角度考虑,则Z试剂可以是____,反应的离子反应方程式为____________,现象是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
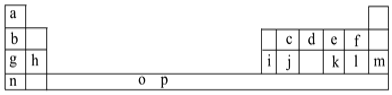
试回答下列问题:
(1)元素p为26号元素,请写出其基态原子电子排布式:___。
(2)d与a反应的产物的分子中中心原子的杂化形式为___,该分子是___(填“极性”或“非极性”)分子。
(3)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:__。
(4)o、p两元素的部分电离能数据列于下表:
元素 | o | p | |
电离能/kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是___。
II.(1)基态硫原子中,核外占据最高能级电子的电子云轮廓图形状为__。硫的一种同素异形体分子式为S8,其结构如图所示,其中S原子的杂化轨道类型为___。S8易溶于二硫化碳的原因是___。
![]()
(2)教材插图具有简洁而又内涵丰富的特点。请回答以下问题:
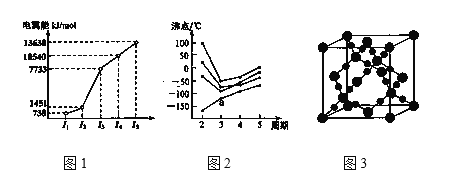
①第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素对应的原子有___种不同运动状态的电子。
②CO2在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于___晶体。
③如图2所示,每条折线表示周期表ⅣA到ⅦA 中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是__。判断依据___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100 mL 0.3 mol·L-1 Na2SO4溶液和50 mL 0.2 mol·L-1 Al2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度为( )
A. 0.20 mol·L-1B. 0.25 mol·L-1
C. 0.40 mol·L-1D. 0.50 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:xA(g)+yB(?) ![]() zC(g);平衡时测得A的浓度为0.45 mol/L,保持温度不变,将容器的容积压缩到原来的一半,再达平衡时,测得A的浓度增大为0.9 mol/L。下列有关判断正确的是
zC(g);平衡时测得A的浓度为0.45 mol/L,保持温度不变,将容器的容积压缩到原来的一半,再达平衡时,测得A的浓度增大为0.9 mol/L。下列有关判断正确的是
A. 各物质的计量数一定满足:x+y=z
B. 若B为气体,压缩后B的体积分数增大,转化率降低
C. 无论B为固体或气体,压缩后B的质量都不会改变
D. 压缩时,平衡向逆反应方向移动,且正、逆反应速率都增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香豆素-3-羧酸![]() 是一种重要的香料,常用作日常用品或食品的加香剂。
是一种重要的香料,常用作日常用品或食品的加香剂。
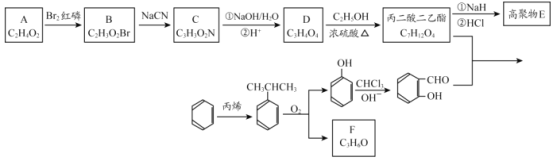
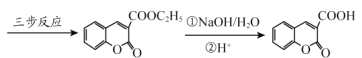
已知:
RCOOR′+ R″OH ![]() RCOOR″ + R′OH(R 代表烃基)
RCOOR″ + R′OH(R 代表烃基)
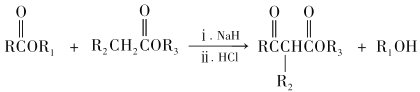
(1)A和B均有酸性,A 的结构简式__________;苯与丙烯反应的类型是_______。
(2)F 为链状结构,且一氯代物只有一种,则F 含有的官能团名称为__________。
(3)D→丙二酸二乙酯的化学方程式:_______。
(4)丙二酸二乙酯在一定条件下可形成聚合物 E,其结构简式为:________。
(5)写出符合下列条件的丙二酸二乙酯同分异构体的结构简式:________。
①与丙二酸二乙酯的官能团相同;
②核磁共振氢谱有三个吸收峰,且峰面积之比为 3:2:1;
③能发生银镜反应。
(6)丙二酸二乙酯与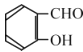 经过三步反应合成
经过三步反应合成 。
。
请写出中间产物的结构简式。
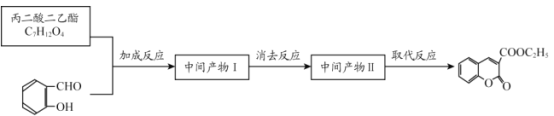
中间产物I__________;中间产物II___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是重要的工业原材料,现有铜、氧化亚铜组成的混合物,某研究性学习小组为了探究其组成情况,取35.2 g混合物加入0.5 L 3.4 mol·L-1的稀硝酸,固体物质完全反应,生成一氧化氮4.48 L(标准状况)。向所得溶液中加入aL 2.0 mol·L-1氢氧化钠溶液,恰好使溶液中的铜离子沉淀完全。
(1)氧化亚铜与稀硝酸反应的化学方程式为_______________。
(2)混合物中,铜的物质的量为____________;氧化亚铜的物质的量为______________。
(3)所加氢氧化钠溶液的体积是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com