
【题目】长期放置的FeSO4溶液易被氧化而变质,某兴趣小组进行了如下实验:
(1)设计实验检验FeSO4溶液的变质程度
实验方案 | 实验现象 | 实验结论 | |
步骤1 | 取待检测液于试管中,向其中滴加KSCN溶液 | ________ | FeSO4溶液部分变质 |
步骤2 | _____ | _________ | |
① 将上述方案补充完整
② 若要使部分变质的FeSO4复原,方法是__________。(写离子反应方程式)
(2)利用部分变质的FeSO4溶液制备Fe2O3
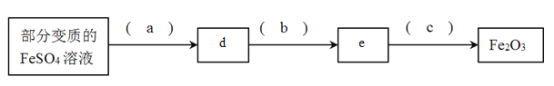
①填写下列各空:a._____b._______c.________d._____e.______
②若100mL该变质溶液制得1.6gFe2O3,则变质前FeSO4溶液的浓度为__________。
(3)FeSO4可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将Fe3+转化为Fe2+,以利于人体吸收。为了验证这一猜想,设计了如下实验:
实验方案 | 实验现象 |
取适量 Fe2(SO4)3溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液。 | 紫色褪去 |
由上述实验能否得出“维生素C可将Fe3+转化为Fe2+”的结论?请说明理由_______。
【答案】溶液变红 取待检测液于试管中,向其中滴加少量酸性高锰酸钾溶液 紫色褪去 2Fe3++ Fe = 3Fe2+ H2O2 NaOH Fe3+ Fe(OH)3 0.2mol/L 不能,维生素C可能过量,也可使高锰酸钾溶液褪色,则无法说明一定有Fe2+生成
【解析】
(1)①要想证明FeSO4溶液部分变质,需要证明溶液中含有Fe3+和Fe2+;
②若要使变质的FeSO4溶液复原,可以向溶液中加入过量的Fe粉,再经过滤除去剩余的Fe粉即可;
(2)①利用部分变质的FeSO4溶液制备Fe2O3的路线为:![]() ;
;
②根据Fe元素守恒进行计算;
(3)Fe2+和维生素C都具有还原性,若维生素C过量,也可使高锰酸钾溶液褪色,则无法说明一定有Fe2+生成。
(1)①要想证明FeSO4溶液部分变质,需要证明溶液中含有Fe3+和Fe2+;步骤1中,向待测液中加入KSCN溶液,溶液变为血红色,说明溶液中含有Fe3+;步骤2中,向待测液中加入酸性KMnO4溶液,酸性KMnO4溶液褪色,说明溶液中含有Fe2+;
②若要使变质的FeSO4溶液复原,可以向溶液中加入过量的Fe粉,再经过滤除去剩余的Fe粉即可,反应的离子方程式为2Fe3++Fe=3Fe2+;
(2)①利用部分变质的FeSO4溶液制备Fe2O3的路线为:![]() ,故a为H2O2,b为Fe2(SO4)3、c为NaOH、d为Fe(OH)3,e为△;
,故a为H2O2,b为Fe2(SO4)3、c为NaOH、d为Fe(OH)3,e为△;
②n(Fe2O3)=![]() =0.01mol,则变质前,100mL FeSO4溶液中,n(FeSO4)=0.02mol,故c(FeSO4)=
=0.01mol,则变质前,100mL FeSO4溶液中,n(FeSO4)=0.02mol,故c(FeSO4)=![]() =0.2mol/L;
=0.2mol/L;
(3)该实验现象不能验证猜想,因为维生素C也具有还原性,若维生素C过量,也可使高锰酸钾溶液褪色,则无法说明一定有Fe2+生成。


科目:高中化学 来源: 题型:
【题目】.某兴趣小组采用10.0 g废易拉罐(含90%的Al,还含有少量的Fe、Mg等杂质)制备明矾[KAl(SO4)2·12H2O]的实验流程如图:

(1)试剂①应选用________(填字母)。
a.盐酸 b.H2SO4溶液 c.氨水 d.NaOH溶液
(2)易拉罐溶解过程中主要反应的化学方程式为__________________________。
(3)从溶液C中得到明矾的实验操作为________、________、过滤,如用图所示装置进行该操作,其中的一处主要错误是______________。
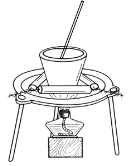
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将充满NO2和O2的试管倒立于水槽中,充分反应后,剩余气体的体积为原混合气体体积的![]() ,则原混合气体中NO2和O2的体积之比是
,则原混合气体中NO2和O2的体积之比是
A.8:1B.7:3C.1:7D.4:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类农业生产离不开氮肥,科学合理使用氮肥,不仅能提高化肥的使用率,而且能够更好地保护环境,请回答下列问题:
(1)将N2转化为含氮化合物的过程称为固氮
① 人工固氮,将N2→NH3, N2发生_________反应
② 自然界固氮,可将少量N2转化为Ca(NO3)2等氮肥,转化途径如下(转化所需试剂及条件已略去):N2→NO→NO2→HNO3![]() Ca(NO3)2。写出NO→NO2→HNO3的化学方程式__________、__________。将HNO3转化为Ca(NO3)2,列举三种不同类别的化合物M_______(写化学式)。
Ca(NO3)2。写出NO→NO2→HNO3的化学方程式__________、__________。将HNO3转化为Ca(NO3)2,列举三种不同类别的化合物M_______(写化学式)。
(2)科学合理地保存、施用氮肥
① NH4HCO3需阴凉处保存,原因是__________(写化学方程式)。
② 铵态氮肥不能与碱性肥料混合使用,以NH4Cl为例写出发生反应的离子方程式________。
(3)过渡施用氮肥将导致大气中NH3含量增高,加剧雾霾的形成。(NH4)2SO4是雾霾的成分之一,其形成过程如下图所示(转化所需试剂及条件已略去):
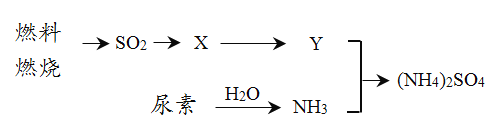
① X可能是______、_______。 Y是___________。
② 尿素CO(NH2)2是一种常用化肥,缓慢与H2O发生非氧化还原反应释放出NH3则尿素中C元素化合价为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 醋酸溶解水垢中的CaCO3: CaCO3 + 2H+= Ca2++ H2O + CO2↑
B. 惰性电极电解饱和MgCl2溶液: Mg2++2Cl- + 2H2O ![]() Mg(OH)2↓ + H2↑ + Cl2↑
Mg(OH)2↓ + H2↑ + Cl2↑
C. 苯酚钠溶液中通入少量的CO2:![]() +H2O+CO2→
+H2O+CO2→ +
+![]()
D. 用银氨溶液检验乙醛中的醛基:CH3CHO+![]() +2OH-
+2OH-![]() CH3COONH4+H2O+2Ag↓+3NH3↑
CH3COONH4+H2O+2Ag↓+3NH3↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A. 依据铝热反应原理,能发生反应2Al+3MgO![]() 3Mg+Al2O3
3Mg+Al2O3
B. 在加入铝粉能放出氢气的溶液中,K+、NH4+、CO32-、Cl-一定能够大量共存
C. 镁铝合金既可完全溶于过量盐酸又可完全溶于过量NaOH溶液
D. 氯化铝溶液中加入过量氨水反应实质是:Al3++3NH3·H2O===Al(OH)3↓+3NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将224 L HCl气体溶于635 mL水中,所得盐酸的密度为1.18 g·cm-3。试计算:
(1)所得盐酸的质量分数和物质的量浓度分别是_______、_______。
(2)取出这种盐酸100 mL,稀释至1.18 L,所得稀盐酸的物质的量浓度是_______。
(3)在40.0 mL 0.065 mol·L-1Na2CO3溶液中,逐渐加入(2)所稀释的稀盐酸,边加边振荡。若使反应不产生CO2气体,加入稀盐酸的体积最多不超过_______mL。
(4)将不纯的NaOH样品1 g(样品含少量Na2CO3和水),放入50 mL 2 mol·L-1的盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40 mL 1 mol·L-1的NaOH溶液。蒸发中和后的溶液,最终得到_______克固体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以![]() 、软锰矿(主要成分为
、软锰矿(主要成分为![]() ,少量
,少量![]() 及
及![]() 的化合物等)、氨水及净化剂等为原料可制备
的化合物等)、氨水及净化剂等为原料可制备![]() 液和
液和![]() ,主要实验步骤如下
,主要实验步骤如下

步骤I、如图所示装置,将![]() 通入
通入![]() 中的软锰矿浆液中
中的软锰矿浆液中![]() 。
。
步骤II、充分反应后,在不断搅拌下依次向仪器![]() 中加入适量纯净的
中加入适量纯净的![]() ,最后加入适量
,最后加入适量![]() 沉铅,
沉铅,
步骤III、过滤得![]() 溶液
溶液
(1)仪器R的名称是_______。
(2)装置![]() 用于制取
用于制取![]() ,反应的化学方程式为_________。
,反应的化学方程式为_________。
(3)装置![]() 中的反应应控制在90~100℃,适宜的加热方式是______________。
中的反应应控制在90~100℃,适宜的加热方式是______________。
(4)装置![]() 的作用是______________________。
的作用是______________________。
(5)“步骤Ⅱ”中加入纯净![]() 的目的是_______________,用
的目的是_______________,用![]() 调节溶液
调节溶液![]() 时,需调节溶液
时,需调节溶液![]() 的范围为________(该实验条件下,部分金属离子开始沉淀和沉淀完全的
的范围为________(该实验条件下,部分金属离子开始沉淀和沉淀完全的![]() 如下表)
如下表)
金属离子 |
|
|
|
|
开始沉淀的 | 7.04 | 1.87 | 3.32 | 7.56 |
沉淀完全的 | 9.18 | 3.27 | 4.9 | 10.2 |
(6)已知①用空气氧化![]() 浊液可制备
浊液可制备![]() ,主要副产物为
,主要副产物为![]() ;反应温度和溶液
;反应温度和溶液![]() 对产品中
对产品中![]() 的质量分数的影响分别如图所示
的质量分数的影响分别如图所示

②反应温度超过![]() 时,
时,![]() 的产率开始降低,
的产率开始降低,![]() 是白色沉淀,
是白色沉淀,![]() 呈黑色;
呈黑色;![]() 、
、![]() 中锰的质量分数理论值依次为72.05%、62.5%请补充完整由步骤III得到
中锰的质量分数理论值依次为72.05%、62.5%请补充完整由步骤III得到![]() 溶液,并用氨水等制备较纯净的
溶液,并用氨水等制备较纯净的![]() 的实验方案:______________________,真空干燥6小时得产品
的实验方案:______________________,真空干燥6小时得产品![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤素互化物如ICl、ICl3等具有与卤素单质相似的性质。利用反应I2+Cl2=2ICl,实验室可用如图所示装置(夹持仪器已略去)制取少量ICl3。已知:ICl的熔点为27.2℃,沸点为97.40C,容易水解,能发生反应:ICI+C12=IC13。下列叙述错误的是( )
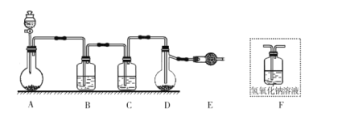
A.圆底烧瓶中的固体可以为KMnO4或KClO3
B.装置B、C中的试剂分别为饱和食盐水和浓硫酸
C.装置E的作用为吸收尾气,可用装置F替代
D.盐酸的滴加速度过快,ICl的产率会明显降低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com