
����Ŀ��һ�������£����Ϊ2L���ܱ������У�2mol X��3mol Y���з�Ӧ��X��g��+Y��g��![]() Z��g������12s�ﵽƽ�⣬����0.6molZ������˵����ȷ����
Z��g������12s�ﵽƽ�⣬����0.6molZ������˵����ȷ����
A. ��XŨ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.05 mol/��Ls��
B. �����������䣬����X��Ũ�ȣ�ƽ�����ƣ�X��ת��������
C. �����������䣬12s�������������Ϊ10L��Z��ƽ��Ũ�ȱ�Ϊ0.06mol/L
D. �����������䣬������1molX��1.5molY���ٴ�ƽ��ʱZ�����ʵ���С��0.3mol
���𰸡�D
��������
������ʽ������
X��g��+Y��g��![]() Z��g��
Z��g��
n��ʼ��mol�� 2 3 0
nת����mol�� 0.6 0.6 0.6
nƽ�⣨mol�� 1.4 2.4 0.6
cƽ�⣨mol/L��0.7 1.2 0.3
A��������=��c/��t�������XŨ�ȱ仯��ʾ�ķ�Ӧ���ʣ�
B������X��Ũ�ȣ�ƽ�����ƣ�X��ת���ʼ�С��
C�������������䣬12s�������������Ϊ10L���൱�ڼ�Сѹǿ��ƽ�������ƶ���
D���൱�ڼ�Сѹǿ��ƽ�������ƶ���
������ʽ������
X��g��+Y��g��![]() Z��g��
Z��g��
n��ʼ��mol�� 2 3 0
nת����mol�� 0.6 0.6 0.6
nƽ�⣨mol�� 1.4 2.4 0.6
cƽ�⣨mol/L��0.7 1.2 0.3
A����XŨ�ȱ仯��ʾ�ķ�Ӧ������=��c/��t=0.6mol��(2L��12s)=0.025 mol/��Ls��,��A����
B������X��Ũ�ȣ�ƽ�����ƣ�X��ת���ʼ�С����B����
C�������������䣬12s�������������Ϊ10L���൱�ڼ�Сѹǿ��ƽ�������ƶ���Z��ƽ��Ũ��С��0.06mol��L��1����C����
D���൱�ڼ�Сѹǿ��ƽ�������ƶ����ٴ�ƽ��ʱZ�����ʵ���С��0.3mol����D��ȷ��
��ѡD��


 ���ٴ���������ѧϰ����ѧ�ں����ν�ϵ�д�
���ٴ���������ѧϰ����ѧ�ں����ν�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�����A��B��C�ֱ�Ϊ���塢����ɫ���塢��ɫ���壬�ں��ʵķ�Ӧ�����£����ǿ��������ͼ���з�Ӧ����֪E��Һ����ɫ�ģ���ش�
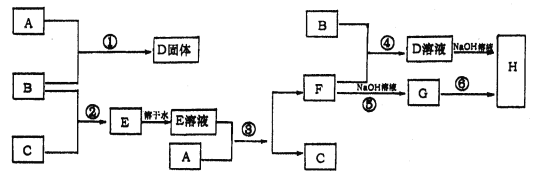
(1)A��_____________��B��______________��C��___________���ѧʽ��
(2)��Ӧ���Ļ�ѧ����ʽΪ��__________________________________________��
(3)��Ӧ�������ӷ���ʽΪ��__________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ�Ӧ��2SO2��O2![]() 2SO3����������������ʱ��ֻ�ı�һ��������������SO3�ķ�Ӧ���ʵı仯�����±����������� ��С�����䡱����
2SO3����������������ʱ��ֻ�ı�һ��������������SO3�ķ�Ӧ���ʵı仯�����±����������� ��С�����䡱����
��� | �ı������ | ���ɵ�SO3������ |
�� | �����¶� | _______ |
�� | �����¶� | _______ |
�� | ����O2��Ũ�� | _______ |
�� | �����³���Ne | _______ |
�� | ѹ����� | _______ |
�� | ʹ�ô��� | _______ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��������һδ֪Ũ�ȵĴ��ᣬijѧ����0.1000 mol��L-1 NaOH����Һ���вⶨ�����Ũ�ȵ�ʵ�飬ȡ20.00mL������������ƿ�У����μ�2~3��ָʾ������NaOH����Һ���еζ����ظ������ζ�����2~3�Σ���¼�������¡����������գ�
ʵ���� | �����������/mL | NaOH��Һ��Ũ��/mol��L-1 | ����NaOH��Һ�����/mL |
1 | 20.00 | 0.1000 | 25.18 |
2 | 20.00 | 0.1000 | 23.06 |
3 | 20.00 | 0.1000 | 22.98 |
��1����ʵ����ָʾ�����ѡ��___________���ζ��ﵽ�յ�ı�־��_____________________��
��2���ų���ʽ�ζ��ܼ��������ݵķ���Ӧ��������_________���������/��/������Ȼ�����ἷѹ������ʹ���첿�ֳ�����Һ��

��3�������������ݣ��ɼ�����ô����Ũ��Ϊ_________mol��L-1������С�����4λ����
��4��������ʵ���У����в���������������ȷ������ɲⶨ���ƫ�ߵ���________��
A���õζ���ȡ20.00mL������ᣬʹ��ǰ��ˮϴ��δ�ô��������ϴ
B����ƿˮϴ��δ����
C������NaOH����ʱ����С����NaOH����
D���ζ��յ����ʱ����
E����ʽ�ζ��ܼ��첿�������ݣ��ζ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ�����ӡˢ��ҽҩ�����ϡ���ˮ�����Լ��л��ϳɴ�����������Ҫ��Ӧ�á���ҵ�ϳ��Է���м������SiO2��Al2O3��MgO��Fe2O3�����ʣ�Ϊԭ���Ʊ��Ȼ�����������������ͼ��
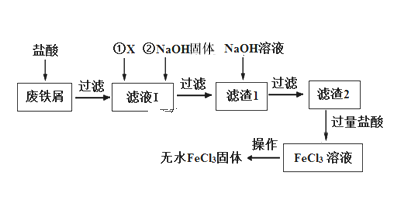
��֪�����������Ksp���±���
�������� | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 |
Ksp | 1.0��10-36 | 1.6��10-14 | 2.0��10-33 | 1.2��10-11 |
��ش��������⣺
��1������X����ѡ�����������е�____��ѡ����ţ�
A��NaCl B��FeCl3 C��H2O2 D��H2SO4
��2����Һ�����NaOH�����Ŀ���ǵ�����Һ��pH�����Լ���NaOH�����Ժ���Һ����ı仯������֪��Һ����c(Fe3+)Ϊ1.0 mol��L-1��c(Al3+)Ϊ0.03 mol��L-1��c(Mg2+)Ϊ0.01 mol��L-1����Fe3+ǡ�ó�����ȫʱ[c(Fe3+)=1��10-5 mol��L-1]��Al3+�Ƿ��Ѿ���ʼ����______����������������������
��3��д������1��NaOH��Һ������Ӧ�����ӷ���ʽ_____________________��
��4�������������������FeCl3��Һ�õ���ˮFeCl3�������IJ�����Ϊ��������һ��������ȴ�ᾧ�õ�FeCl3��6H2O���壻�ڶ���������ˮFeCl3���塣�ڶ�������ȷ������_____��
��5��FeCl3���о�ˮ���ã�����ʴ�豸�����ۺ��Ȼ�����һ�����͵���������������ˮ��FeCl3��Ч���Ҹ�ʴ��С��
��FeCl3��ˮ��ԭ����____________________�������ӷ���ʽ��ʾ��
��ͨ�������������ɾۺ��Ȼ��������ӷ���ʽΪxFe3����yH2O![]() Fex(OH)y(3x-y)+��yH���������Ӿۺ��Ȼ����IJ��ʿɲ�ȡ�ķ�����_____������ĸ����
Fex(OH)y(3x-y)+��yH���������Ӿۺ��Ȼ����IJ��ʿɲ�ȡ�ķ�����_____������ĸ����
a�����¡� b���Ӱ�ˮ c������NH4Cl d������NaHCO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Լ���������ķ�Ӧ����ͼ��ʾ����������ȷ���ǣ�������
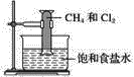
A.�÷�Ӧ����ȡ����Ӧ
B.�÷�Ӧ�������ǹ���
C.�÷�Ӧ��������������
D.��Ӧ����Ͳ��Һ����������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25���£�������ʵĵ���ƽ�ⳣ��![]() ������˵����ȷ���ǣ� ��
������˵����ȷ���ǣ� ��
A.��0.1mol/L������ζ�0.1mol/L�İ�ˮʱ�����÷�̪��ָʾ��
B.0.2mol/L�Ĵ�����0.1mol/L������������Һ�������ϣ�������Һ�У�![]()
C.pH=3��������pH=11�İ�ˮ�������ϣ�������Һ��![]()
D.pH=3�Ĵ�����pH=11�İ�ˮ�������ϣ�������Һ����ˮ�������![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijģ��"�˹���Ҷ���绯ѧʵ��װ����ͼ��ʾ����װ���ܽ�H2O��CO2ת��ΪO2��ȼ��(C3H8O)������˵����ȷ����
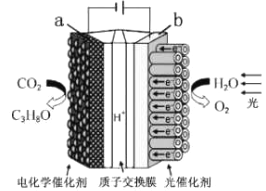
A. ��װ�ý���ѧ��ת��Ϊ���ܺ͵���
B. ��װ�ù���ʱ��H����b������a����Ǩ��
C. ÿ����1 mol O2����44 gCO2����ԭ
D. a�缫�ķ�ӦΪ��3CO2+ 16H��-18e��= C3H8O+4H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڴ��Թ��ڽ�����NaHCO3���ȵ� 200�����������Ļ������ͨ�뵽ʢ��1.87 g Na2O��Na2O2���ܱ������У���Na2O��Na2O2ȫ����Ӧ�õ���״����224 mL O2���ٽ���Ӧ���ܱ������ڵĹ���ȫ������ˮ��� 100 mL ��Һ������˵����ȷ����
A.Na2O��Na2O2 ������������
B.�μӷ�Ӧ��NaHCO3���ʵ���Ϊ 0.04 mol
C.��Ӧ�������ܹ�ת�� 0.04 mol ����
D.��ɵ� 100 mL ��Һ�� c(Na+) = 0.5 mol/L
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com