
【题目】近年来雾霾天气多次肆虐我国中东部地区,其中汽车尾气和燃煤尾气是造成空气污染的原因之一。有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
(1)在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质。主要原理为:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)。
2CO2(g)+N2(g)。
①该反应的平衡常数表达式为______________。
②在密闭容器中发生该反应时,c(CO2)随温度(T)和时间(t)的变化曲线如下图1所示。据此判断该反应的△H_______0(填“>”或“<”),在T1温度下,02 s内N2的平均反应速率v(N2) =________。
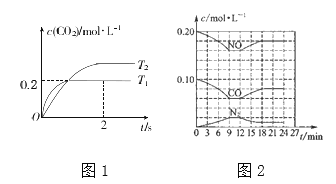
③将0.2mol NO和0.1mol CO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如上图2所示。第12min时改变的反应条件可能为______________。
A.升高温度 B.加入NO C.加催化剂 D.降低温度
(2)工业上常采用“低温臭氧氧化脱硫脱硝”技术来同时吸收氮的氧化物(NOx))和SO2气体,在此过程中还获得了(NH4)2SO4的稀溶液。
①在(NH4)2SO4溶液中,水的电离程度受到了_______(填“促进”、“抑制”或“没有影响)”
②若往(NH4)2SO4溶液中加入少量稀盐酸,则 值将_________(填“变大”、“变小”或“不变”)。
值将_________(填“变大”、“变小”或“不变”)。
(3)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气中含有氮的氧化物,用CH4催化还原NOx可消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867.0 kJ·mol-1
2NO2(g) ![]() N2O4(g) △H = - 56.9 kJ·mol-1
N2O4(g) △H = - 56.9 kJ·mol-1
则CH4催化还原N2O4(g)生成N2和H2O(g)的热化学方程式为______________。
(2)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。下图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。电极b作______极,表面发生的电极反应式为________________。

【答案】 K= < 0.05 mol·L-1·s-1 D 促进 变大 CH4(g)+N2O4 (g)=N2(g)+CO2(g)+2H2O(g) △H=-810.1 kJ·mol-1 正 CO2+2e-+2H+=HCOOH
< 0.05 mol·L-1·s-1 D 促进 变大 CH4(g)+N2O4 (g)=N2(g)+CO2(g)+2H2O(g) △H=-810.1 kJ·mol-1 正 CO2+2e-+2H+=HCOOH
【解析】试题分析:本题以氮氧化物、碳氧化物和硫氧化物的处理为载体,重点考查平衡常数的表达式、化学反应速率的计算、化学平衡的移动、盐类的水解、盖斯定律、原电池原理等知识,考查考生对原电池原理的综合分析能力和对化学平衡图像的分析能力。
解析:(1)①平衡常数是一定条件下,产物浓度的系数次方除以反应物浓度系数次方。正确答案:K= 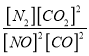 。②从图像可以看出,T1温度反应先达到平衡状态,所以温度T1>T2,以T2为参照,温度更高(T1)时CO2的浓度较低,即升高温度,平衡逆向移动,所以正反应为放热反应,△H<0。0~2s内,反应生成的CO2浓度为0.2mol/L,所以v(N2)=v(CO2)/2=0.2mol/L÷2s÷2=0.05mol/(L·s)。正确答案:<、0.05mol/(L·s)。③第12s时,从图中可以读出瞬时各物质浓度都没有变化,随后NO、CO浓度减小,N2浓度增大,说明平衡正向移动。前面已经推出该反应为放热反应,所以升高温度平衡逆向移动,所以A错误;加入NO会导致第12 s时NO浓度增大,所以B错误;催化剂不影响化学平衡,所以C错误;降低温度时,12s瞬时各物质浓度不变,平衡正向移动,这些都符合图像变化趋势,D正确。正确答案:D 。(2)①(NH4)2SO4溶液中NH4+水解能够促进水的电离,正确答案:促进。②加入的HCl会抑制NH4+水解,使得溶液中NH4+浓度增大,所以
。②从图像可以看出,T1温度反应先达到平衡状态,所以温度T1>T2,以T2为参照,温度更高(T1)时CO2的浓度较低,即升高温度,平衡逆向移动,所以正反应为放热反应,△H<0。0~2s内,反应生成的CO2浓度为0.2mol/L,所以v(N2)=v(CO2)/2=0.2mol/L÷2s÷2=0.05mol/(L·s)。正确答案:<、0.05mol/(L·s)。③第12s时,从图中可以读出瞬时各物质浓度都没有变化,随后NO、CO浓度减小,N2浓度增大,说明平衡正向移动。前面已经推出该反应为放热反应,所以升高温度平衡逆向移动,所以A错误;加入NO会导致第12 s时NO浓度增大,所以B错误;催化剂不影响化学平衡,所以C错误;降低温度时,12s瞬时各物质浓度不变,平衡正向移动,这些都符合图像变化趋势,D正确。正确答案:D 。(2)①(NH4)2SO4溶液中NH4+水解能够促进水的电离,正确答案:促进。②加入的HCl会抑制NH4+水解,使得溶液中NH4+浓度增大,所以 值增大。正确答案:变大。(3)①将反应Ⅰ减去反应Ⅱ得CH4(g)+ N2O4(g)=N2(g)+CO2(g)+2H2O(g) ,反应的焓变 △H=-867.0 kJ·mol-1-(- 56.9) kJ·mol-1=-810.1 kJ·mol-1。正确答案:CH4(g)+ N2O4(g)=N2(g)+CO2(g)+2H2O(g) △H=-810.1 kJ·mol-1。②从图示可以看出,原图左侧H2O转变成O2,O元素被氧化,电极a为负极,反应原理为2H2O-4e-=4H++O2↑,H+通过质子交换膜进入右侧发生反应,右侧通入的CO2转变成HCOOH,C元素被还原,电极b为正极,反应原理为CO2+2e-+2H+=HCOOH。正确答案:正、 CO2+2e-+2H+=HCOOH。
值增大。正确答案:变大。(3)①将反应Ⅰ减去反应Ⅱ得CH4(g)+ N2O4(g)=N2(g)+CO2(g)+2H2O(g) ,反应的焓变 △H=-867.0 kJ·mol-1-(- 56.9) kJ·mol-1=-810.1 kJ·mol-1。正确答案:CH4(g)+ N2O4(g)=N2(g)+CO2(g)+2H2O(g) △H=-810.1 kJ·mol-1。②从图示可以看出,原图左侧H2O转变成O2,O元素被氧化,电极a为负极,反应原理为2H2O-4e-=4H++O2↑,H+通过质子交换膜进入右侧发生反应,右侧通入的CO2转变成HCOOH,C元素被还原,电极b为正极,反应原理为CO2+2e-+2H+=HCOOH。正确答案:正、 CO2+2e-+2H+=HCOOH。


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
【题目】我国本土科学家屠呦呦因为发现青蒿素而获得2015年的诺贝尔生理和医学奖。己知二羟甲戊酸是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是
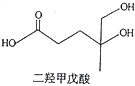
A. 与乙醇发生酯化反应生成产物的分子式为C8H18O4
B. 在铜的催化下与氧气反应的产物可以发生银镜反应
C. 标准状况下1mol该有机物可以与足量金属钠反应产生22.4L H2
D. 能发生加成反应,不能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛和钛合金被认为是21世纪的重要材料,它们具有很多优良的性能,如熔点高、密度小、可塑性好、易于加工,钛合金与人体有很好的“相容性”。根据它们的主要性能,下列用途不切合实际的是
A.用来做保险丝 B.用于制造航天飞机
C.用来制造人造骨 D.用于制造船舶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳元素是构成细胞的最基本元素,对此最有说服力的解释是( )
A. 碳在细胞的各种化合物中含量最多 B. 碳在自然界中含量最为丰富
C. 在细胞的各种化合物中都含有碳 D. 碳链构成了生物大分子的基本骨架
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,4﹣环己二醇是一种重要的化工原料,它可通过下列路线合成:

(1)反应⑧的反应类型是__________。
(2)有机物C按照系统命名,其名称是:_______,D中的官能团名称是______________。
(3)写出反应⑤的化学方程式为___________________________________。
(4)环己烷的一种同分异构体W,已知W分子中所有碳原子均在同一平面上,写出其结构简式_______________________,写出比W的相对分子质量少14的同系物中有顺反异构的顺式异构体的结构简式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氯甲烷(CH3Cl)一种重要的化工原料,常温下它是无色有毒气体,微溶于水,易溶于乙醇、CCl4等有机浓剂。
(1)甲组同学在实验室用下图所示装置模拟催化法制备和收集一氯甲烷。
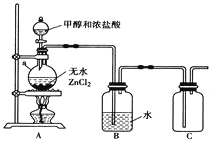
①装置A中仪器a的名称为__________,a瓶中发生反应的化学方程式为_________________。
②实验室干燥ZnCl2晶体制备无水ZnCl2的方法是________________。
③装置B的主要作用是_________________。
④若将收集到的CH3Cl气体在足量的氧气中充分燃烧,产物用过量的V1mL、c1mol·L-1Na OH溶液充分吸收。现以甲基橙作指示剂,用c2mol·L-1盐酸标准溶液对吸收液进行返滴定,最终消耗V2mL盐酸。则所收集CH3C1的物质的量为________mol。(已知:2CH3Cl+3O2![]() 2CO2+2H2O+2HCl)
2CO2+2H2O+2HCl)
(2)为探究CH3Cl与CH4分子稳定性的差别,乙组同学设计实验验证CH3C1能被酸性KMnO4溶液氧化。
①将甲组装置制备的CH3Cl气体通过盛有酸性KMnO4溶液的洗气瓶,如果观察到溶液中__________,则说明CH3Cl比CH4分子稳定性弱。
②实验过程中还产生了一种黄绿色气体和一种无色气体,该反应的离子方程式为________________。
(3)丙组同学选用甲组A、B装置和下图所示的部分装置检验CH3Cl中的氯元素。
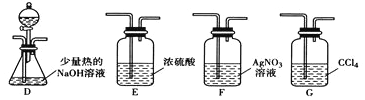
①丙组同学的实验装置中,依次连接的合理顺序为A、B、_________。
②D中分液漏斗中盛放的试剂是硝酸酸化的硝酸银溶液。通入一段时间的CH3Cl气体后,打开分液漏斗的活塞,观察实验现象,能证明CH3Cl中含有氯元素的实验现象是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下列方法制氯气时所得的氯气( )
①用含146 g HCl的浓盐酸与足量的MnO2反应
②用87 g MnO2与足量浓盐酸反应
A.①比②多 B.②比①多 C.一样多 D.无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学物质在生活中有着广泛的应用,下列对应关系错误的是
选项 | 性质 | 应用 |
A | 镁铝合金强度大、质量轻、抗腐蚀能力强 | 制造飞机 |
B | 晶体硅化学性质稳定,能导电 | 制造光纤 |
C | 稀硫酸能与Fe2O3反应 | 除去钢铁表面的铁锈 |
D | NaHCO3受热易分解 | 作焙制糕点的发酵粉 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com