
【题目】我国本土科学家屠呦呦因为发现青蒿素而获得2015年的诺贝尔生理和医学奖。己知二羟甲戊酸是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是
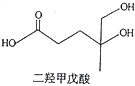
A. 与乙醇发生酯化反应生成产物的分子式为C8H18O4
B. 在铜的催化下与氧气反应的产物可以发生银镜反应
C. 标准状况下1mol该有机物可以与足量金属钠反应产生22.4L H2
D. 能发生加成反应,不能发生取代反应
科目:高中化学 来源: 题型:
【题目】将纯铁片和纯铜片按下图所示插入同浓度的稀硫酸中一段时间,下列叙述正确的是
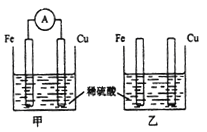
A. 甲装置中电能转化为化学能
B. 两个装置中铜片表面均有气泡产生
C. 甲装置中H+移向铜片发生还原反应
D. 甲中负极上发生的电极反应为Fe-3e-=Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氧磷(化学式:POCl3)常用作半导体掺杂剂及光导纤维原料。氯化水解法生产三氯氧磷的流程如下:

(1)氯化水解法生产三氯氧磷的化学方程式为___________________________。
(2)氯化水解法生产三氯氧磷时,会产生含磷(主要为H3PO3、H3PO4等)废水,已知H3PO3是一种淡黄色晶体,且易溶于水的二元弱酸。
①若用20 mL H3PO3溶液与同浓度的NaOH溶液40mL恰好完全反应,生成的盐为___________________(填“正盐”或“酸式盐”)。
②H3PO3中,P元素的化合价为_______________________。H3PO3可以将溶液中的Ag+还原,从而用于化学镀银,写出该离子方程式_________________________。
③处理废水时,先在其中加入适量漂白粉,再加入生石灰调节pH将磷元素转化为磷酸钙沉淀并回收,加入漂白粉的作用是______________________________________。
④若处理后的废水中c(PO43ˉ)=4×10ˉ7mol·Lˉ1,溶液中c(Ca2+)=________mol·Lˉ1。(已知Ksp[Ca3(PO4)2]=2×10ˉ29)
(3)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
Ⅰ.取a g产品于锥形瓶中,加入足量NaOH溶液,待完全水解后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入0.1000 mol·Lˉ1的AgNO3溶液40.00 mL,使Cl-完全沉淀。
Ⅲ.向其中加入2 mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
Ⅳ.加入指示剂,用c mol·Lˉ1 NH4SCN溶液滴定过量Ag+至终点,记下所用体积。
已知:Ksp(AgCl)=3.2×10ˉ10,Ksp(AgSCN)=2×10ˉ12
①滴定选用的指示剂是__________(选填字母)。
a.FeCl2b.NH4Fe(SO4)2 c.淀粉 d.甲基橙
②实验过程中若未加入硝基苯这项操作,所测Cl元素含量将会_______(填“偏大”、“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在生物体内含量极少,但对于维持生物体的正常生命活动必不可少的元素有( )
A. Fe、Mn、Zn、Cu B. Zn、Cu、Mg、Ca
C. Zn、Mg、B、Mn D. Mg、Mn、Cu、Mo
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于某有机物的性质叙述不正确的是
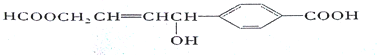
A. 1 mol该有机物完全燃烧可生成12molCO2
B. lmol该有机物分别与足量Na或NaHCO3反应,产生的气体分子数目相等
C. 1 mol该有机物可以与5mol H2发生加成反应
D. 1 mol该有机物可以与2 molNaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素X、Y的核电荷数分别是a和b,它们的离子Xm+和Yn-的核外电子排布相同,则下列关系式正确的是( )
A. a=b+m+n B. a=b-m+n C. a=b+m-n D. a=b-m-n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】充分燃烧2.8g某有机物A,生成8.8g CO2和3.6g H2O,这种有机物蒸气的相对密度是相同条件下N2的2倍。
(1)求该有机物的分子式。
(2)该有机物链状同分异构体的结构简式为: 。
(3) 若有机物A在核磁共振氢谱中只有一个信号峰(即只有一种氢原子),则用键线式表示的结构简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来雾霾天气多次肆虐我国中东部地区,其中汽车尾气和燃煤尾气是造成空气污染的原因之一。有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
(1)在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质。主要原理为:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)。
2CO2(g)+N2(g)。
①该反应的平衡常数表达式为______________。
②在密闭容器中发生该反应时,c(CO2)随温度(T)和时间(t)的变化曲线如下图1所示。据此判断该反应的△H_______0(填“>”或“<”),在T1温度下,02 s内N2的平均反应速率v(N2) =________。
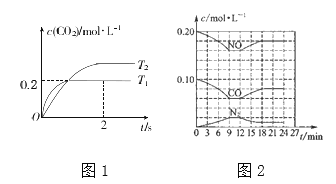
③将0.2mol NO和0.1mol CO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如上图2所示。第12min时改变的反应条件可能为______________。
A.升高温度 B.加入NO C.加催化剂 D.降低温度
(2)工业上常采用“低温臭氧氧化脱硫脱硝”技术来同时吸收氮的氧化物(NOx))和SO2气体,在此过程中还获得了(NH4)2SO4的稀溶液。
①在(NH4)2SO4溶液中,水的电离程度受到了_______(填“促进”、“抑制”或“没有影响)”
②若往(NH4)2SO4溶液中加入少量稀盐酸,则 值将_________(填“变大”、“变小”或“不变”)。
值将_________(填“变大”、“变小”或“不变”)。
(3)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气中含有氮的氧化物,用CH4催化还原NOx可消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867.0 kJ·mol-1
2NO2(g) ![]() N2O4(g) △H = - 56.9 kJ·mol-1
N2O4(g) △H = - 56.9 kJ·mol-1
则CH4催化还原N2O4(g)生成N2和H2O(g)的热化学方程式为______________。
(2)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。下图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。电极b作______极,表面发生的电极反应式为________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com