
����Ŀ���л���J���ҹ������ɹ��з���һ����ҩ���ϳ�J��һ��·����ͼ��
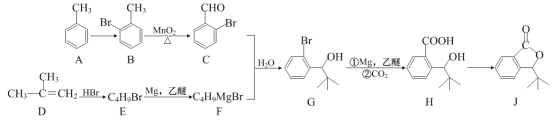
��1����A����B�ķ�Ӧ������Լ�����Ӧ����Ϊ___��
��2����B����C�ķ�Ӧ����Ϊ___��
��3��D___����д����������������������˳���칹����
��4��C������������ͭ��Ӧ�Ļ�ѧ����ʽΪ___(�������±����ϵ��岻���뷴Ӧ)��
��5��д��ͬʱ��������������J��һ��ͬ���칹��Ľṹ��ʽ___��
�ٷ����г������ⲻ��������״�ṹ��
���ܷ���������Ӧ��
�۷�����ֻ������2�ֲ�ͬ��ѧ�������⡣
��6��д�����Ҵ�������Ϊԭ���Ʊ�![]() �ĺϳ�·��ͼ___�����Լ����������ã��ϳ�·��ͼʾ����������ɣ���
�ĺϳ�·��ͼ___�����Լ����������ã��ϳ�·��ͼʾ����������ɣ���
���𰸡�Һ�塢�廯�� ������Ӧ ������  +NaOH+2Cu(OH)2
+NaOH+2Cu(OH)2![]()
 +Cu2O��+3H2O
+Cu2O��+3H2O 
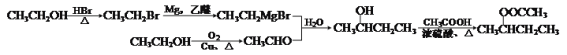
��������
A�Ǽױ�������λ�ⱻ��ԭ��ȡ������B��B�ϼ���������������ΪC������C��F��Ӧ����G����G�Ľṹ�к�������������FΪ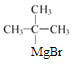 ����֪EΪ
����֪EΪ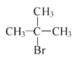 ��D�����ӳɷ�Ӧ����E ��G������ת��ΪH��H�����ڷ���������Ӧ����J��
��D�����ӳɷ�Ӧ����E ��G������ת��ΪH��H�����ڷ���������Ӧ����J��
(1)A��λ�ⱻ��ԭ��ȡ������B�������ڱ���Һ��ķ�Ӧ������������Լ�����Ӧ����ΪҺ�塢�廯����
(2) B�ϼ���������������Ϊȩ������Ӧ����Ϊ������Ӧ��
(3)D˫��̼ԭ���У�һ��̼����������ԭ�ӣ���һ��̼���������������Բ�����˳���칹����
(4)C�����е�ȩ��������������ͭ��������Cu2Oש��ɫ��������Ӧ�Ļ�ѧ����ʽΪ +NaOH+2Cu(OH)2
+NaOH+2Cu(OH)2![]()
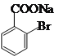 +Cu2O��+3H2O��
+Cu2O��+3H2O��
(5)J��һ��ͬ���칹���ܷ���������Ӧ������ȩ����������ֻ������2�ֲ�ͬ��ѧ�������⣬˵���ṹ�߶ȶԳƣ���������������ԭ�ӣ���ṹ��Ӧ��������ȩ�����������ĸ�̼��ֻ��һ����ԭ�ӣ���ṹ��Ϊ�ĸ��������ݽṹ�߶ȶԳ��ҳ������ⲻ��������״�ṹ����ṹ��ʽֻ��һ�֣� ��
��
(6) ![]() Ϊ������Ӧ���������
Ϊ������Ӧ���������![]() ����������Ӧ���ɣ�������Ŀת����ϵC��F����J����֪
����������Ӧ���ɣ�������Ŀת����ϵC��F����J����֪![]() ����ȩ��CH3CH2MgBr���ɣ���ȩ���Ҵ����������ɣ�CH3CH2MgBr��CH3CH2Br���ɣ�CH3CH2Br��CH3CH2OH���ɣ��ʺϳ�·��Ϊ��
����ȩ��CH3CH2MgBr���ɣ���ȩ���Ҵ����������ɣ�CH3CH2MgBr��CH3CH2Br���ɣ�CH3CH2Br��CH3CH2OH���ɣ��ʺϳ�·��Ϊ��




| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ɸ�������ɺ����ʽ��з��ࡣ
��1����ͼ��ʾ�����ʷ������������______________��
��2��
������� | �� | �� | �� | ������ | �⻯�� |
��ѧʽ | ��HCl ��______ | ��________ ��Ba��OH��2 | ��Na2CO3 ��_______ | ��CO2 ��Na2O | ��NH3 ��H2O2 |
��Na��K��H��O��C��S��N�������ֻ�����Ԫ����ɺ��ʵ����ʣ��ֱ������ϱ��Тڢۢ��档
��3��д����ת��Ϊ�ݵĻ�ѧ����ʽ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.��������
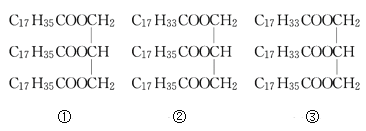
��1�����ڼ���������(����ţ���ͬ)____�����ڻ�ϸ���������______��
��2���ٷ���������Ӧ�Ļ�ѧ����ʽΪ________��
��.���������Ӧʵ�飺��AgNO3��Һ����μ��백ˮ����ʼʱ��AgNO3��Һ�г��ְ�ɫ��������Ӧ�����ӷ���ʽΪ_____���������백ˮ�������ܽ⣬��Ӧ�Ļ�ѧ����ʽΪ____���ߵα���ֱ�ε�______Ϊֹ���ټ�����ȩ��Һ��ˮԡ����������____����ѧ����ʽΪ��______
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������(![]() )����������ҵ����Ӱ������ҵ�Ͽ��÷�Ӧ��
)����������ҵ����Ӱ������ҵ�Ͽ��÷�Ӧ��
![]() �Ƶá�ʵ����ģ��ù�ҵ�����Ʊ������������Һ��װ����ͼ����
�Ƶá�ʵ����ģ��ù�ҵ�����Ʊ������������Һ��װ����ͼ����
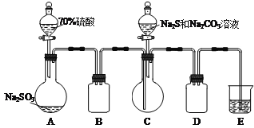
(1)װ��A�з�Ӧ�Ļ�ѧ����ʽ___��
(2)װ��B��D��������___��
(3)E�е��Լ���___��
(4)��Ӧһ��ʱ���װ��C�еõ���Ʒ��![]() �����л�����������
�����л�����������![]() ��Ϊ�ⶨװ��C��Һ��
��Ϊ�ⶨװ��C��Һ��![]() ��
��![]() �����ʵ���Ũ��֮�ȣ��ֽ�������ʵ�飺
�����ʵ���Ũ��֮�ȣ��ֽ�������ʵ�飺
�����ȡ![]() װ��C��ƿ�ڵ���Һ������ƿ�У�����������
װ��C��ƿ�ڵ���Һ������ƿ�У�����������![]() ��Һ���ټ�������
��Һ���ټ�������![]() ��Һ����ַ�Ӧ���ˣ�ϴ�ӣ�����õ����������Ϊ
��Һ����ַ�Ӧ���ˣ�ϴ�ӣ�����õ����������Ϊ![]() ��
��
�������ȡ![]() װ��C��ƿ�ڵ���Һ������ƿ�У��Ե�����ָʾ������
װ��C��ƿ�ڵ���Һ������ƿ�У��Ե�����ָʾ������![]() �����Һ�ζ����ζ����յ����ĵ�ı���Һ���Ϊ
�����Һ�ζ����ζ����յ����ĵ�ı���Һ���Ϊ![]() ���ò����з����ķ�ӦΪ
���ò����з����ķ�ӦΪ![]() ������װ��C��Һ��
������װ��C��Һ��![]() ��
��![]() �����ʵ���Ũ��֮��___��д��������̣���
�����ʵ���Ũ��֮��___��д��������̣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�������2L�����ܱ�������Ͷ��һ������A��B������Ӧ��3A(g)+bB(g)![]() cC(g) H=��QkJ��mol��1��Q��0����12sʱ����C�����ʵ���Ϊ0.8mol����Ӧ������ͼ��ʾ��������˵������ȷ����
cC(g) H=��QkJ��mol��1��Q��0����12sʱ����C�����ʵ���Ϊ0.8mol����Ӧ������ͼ��ʾ��������˵������ȷ����
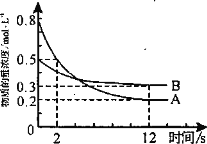
A. 2sʱ��A�ķ�Ӧ����Ϊ0.15mol��L��1��s��1
B. ͼ�н���ʱA���������ʵ���A����������
C. ��ѧ������֮��b ��c = 1��2
D. 12s�ڷ�Ӧ�ų�0.2QkJ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��4FeO42��+10H2O�T4Fe��OH��3��+8OH��+3O2�������c��FeO42�����ڲ�ͬ�����±仯��ͼ�ס��ҡ���������ʾ��
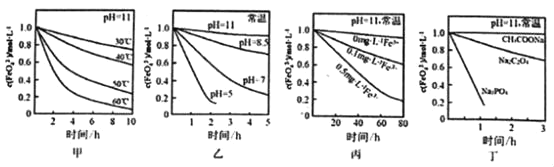
����˵����ȷ���ǣ� ��
A.ͼ�ױ���������������ͬʱ���¶�Խ��FeO42��ת������Խ��
B.ͼ�ұ���������������ͬʱ������ԽǿFeO42��ת������Խ��
C.ͼ������������������ͬʱ������������Fe3+�ܼӿ�FeO42����ת��
D.ͼ������������������ͬʱ�����ζ���FeO42���������ȶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ��Ӧ��һ��dz���Ҫ�ķ�Ӧ���ش��������⣺
��1������ͼ��ʾ��������ַ�Ӧ��
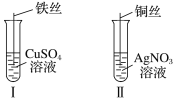
�����з�����Ӧ�����ӷ���ʽΪ__________________________________��
������ͭ˿�Ϲ۲쵽��������___________________________________��
�۽��������ʵ�������֪Fe2����Cu2����Ag������������ǿ������˳��Ϊ_____________��
��2����ҩ���й������Ĵ�����֮һ����Զֵ�������セ�����ڻ�ҩ�ڷ�����ըʱ���������·�Ӧ��2KNO3��3C��S===K2S��N2����3CO2������������������________
��3�������ڵ���Ԫ������Fe2����Fe3������ʽ���ڡ�Fe2���ױ��������գ�����ά����C����ʹFe3��ת����Fe2�����������������գ�˵��ά����C����_______��������ԡ���ԭ�ԡ�����
��4���г��ϳ��۵�ij����Ƭ�к�������ԭ�����ۣ���Щ����������θ��(��Ҫ�ɷ�������)��������ת���������Ρ��˷�Ӧ�Ļ�ѧ����ʽΪ________________________________________________
��5��д��������ԭ����ͭ��Ӧ�Ļ�ѧ����ʽ������˫���ŷ���ʾ����ת�Ƶķ������Ŀ��________________________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ijԭ���ڴ����������״̬ʱ����Χ�����Ų�Ϊ![]() ��������˵���������
��������˵���������
A. ��Ԫ�ؿ�����+3��
B. ��Ԫ��λ�ڵ�5���ڸ���
C. ��Ԫ��ԭ�Ӻ����39����ͬ�˶�״̬�ĵ���
D. ��Ԫ�ػ�̬ԭ�ӵ�N�ܲ��ϻ���5���չ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ���������ɫ��Դ����������͵õ����Ҵ���ȡ�������������õ�Ӧ��ǰ�����Ҵ�ˮ������������IJ��ַ�Ӧ��������ͼ��ʾ��

��֪����ӦI�ͷ�ӦII��ƽ�ⳣ�����¶ȱ仯������ͼ��ʾ��
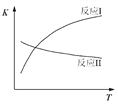
��1����ӦI�У�1 mol CH3CH2OH(g)���뷴Ӧ��������仯��256 kJ��
�� H2O�ĵ���ʽ�ǣ�_________________��
�� ��ӦI���Ȼ�ѧ����ʽ�ǣ�___________________________��
��2����ӦII���ڽ�����[n(CO) : n(H2O)]��ͬʱ�������Ӧ��CO��ƽ��ת���ʼ���ͼ�������Ӧ�ķ�Ӧ�¶ȿ�����ͬ��Ҳ���ܲ�ͬ����
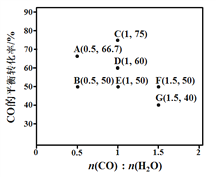
�� ͼ��D��E�����Ӧ�ķ�Ӧ�¶ȷֱ�ΪTD��TE���жϣ�TD_______TE���������� ������������������
�� ��������A��E��G�����Ӧ�ķ�Ӧ�¶���ͬ����ԭ����A��E��G�����Ӧ��____��ͬ��
�� ����ͬ�Ľ����ȴﵽ��ͬ��COƽ��ת����ʱ����Ӧ�ķ�Ӧ�¶Ⱥͽ����ȵĹ�ϵ��______��
��3����ӦIII���ھ�CO2���ʹ�����KHCO3���Һ�У����CO2�Ʊ��Ҵ���ԭ������ͼ��ʾ��
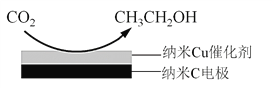
�� �����ĵ缫��Ӧʽ��__________________________��
�� �ӵ�����Һ�з�����Ҵ��IJ���������______________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com