
����Ŀ��Na2SO3��Һ��Ϊ����Һ����SO2ʱ������ҺpH��n(SO32-)��n(HSO3-)�仯ͼ����ͼ��
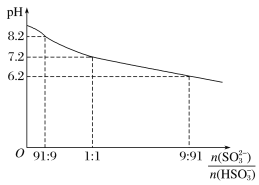
����������Ũ�ȹ�ϵ���ж���ȷ����
A. NaHSO3��Һ��c(H��)��c(OH��)
B. Na2SO3��Һ��c(Na��)��c(SO32-)��c(HSO3-)��c(OH��)��c(H��)
C. ��������Һ������ʱ��c(Na��)��c(SO32-)��c(HSO3-)��c(OH��)��c(H��)
D. ��������Һ������ʱ��c(Na��)��c(HSO3-)��c(SO32-)
���𰸡�D
��������
��Na2SO3��Һ����SO2ʱ���������յ����࣬��Һ�ɼ�����Ϊ���ԡ�
A.��ͼ����Ϣ����֪��NaHSO3��ҺΪ������Һ��c(H��)��c(OH��)����A����
B.Na2SO3��Һ��SO32-��ˮ����ڶ���ˮ�⣬�������������ˮ��̶Ƚ�С����ˮ����Ҳ�������������ӣ�����c(HSO3-)ӦС��c(OH��)����B����
C.��ͼ�����ݣ���c(SO32-)=c(HSO3-)ʱ��pH=7.2���ʵ�����Һ������ʱ�����Ƴ�c(SO32-)��c(HSO3-)����C����
D.��c(OH��)��c(H��)�����ݵ���غ㣬c(Na��)=c(HSO3-)+2 c(SO32-)����������c(Na��)��c(HSO3-)��c(SO32-)����D��ȷ��
��ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ƿ��ǩ���Լ����ֱ�ʢ��AgNO3��Һ��ϡ���ᡢ���ᡢ�Ȼ�����Һ��̼�����Һ��Ϊ��ȷ����ƿ����ʲô�Լ���������������ΪA��B��C��D��E����С�Թܸ�ʢ������ν���������Ϸ�Ӧ����Ӧ����Ϊ��A��B��A��E���ɲ�����ɫ����������A��B��Ӧ�����������������ᣬA��E��Ӧ�����ɵİ�ɫ������������C��D��B��D��B��E����������E��C��E��D��Ӧ���ɲ���������̼���壻��C��D��������ͬһ�����ʣ����ʱ��Ӧ����
�ɴˣ����ж����Լ�ƿ����ʢ�Լ�Ϊ���û�ѧʽ��ʾ��
A________��B________��C________��D________��E________��
���⣬��д������Ҫ������ӷ���ʽ��
(1)A��E��
________________________________________________________��
(2)A��B��
_________________________________________________________��
(3)C��E��
__________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ�������й�������ȷ���ǣ� ��
A.�ڱ����1mol N2�����Ϊ22.4L/mol
B.��������ΪNA��NO2��CO2��������к��е���ԭ����Ϊ2NA
C.1Lһ����̼����һ����1L����������С
D.���³�ѹ�£�8g O3�к���8NA������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����贿����NaCl���壬�����е�NaCl�����л���������Na2SO4��NH4HCO3��Ϊ��ȥ���ʣ���ͬѧ���������ʵ��:(��֪NH4HCO3 ![]() NH3��+H2O+CO2��)
NH3��+H2O+CO2��)
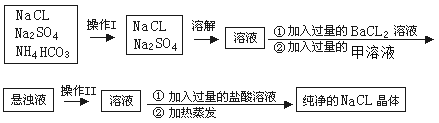
(1)��������I��II�����Ʒֱ�Ϊ______��_______
(2)���в��������������BaCl2��Һ��ʱ������ж�BaCl2��Һ�ѹ������䷽����______________________________________________________
(3)��������������ļ���Һ��������ҺΪ______��Һ���˲�����Ŀ����________________________��
(4)���������������������Һ����Ŀ����________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ��CuS��MnS��ˮ�еij����ܽ�ƽ��������ͼ��ʾ������˵���������
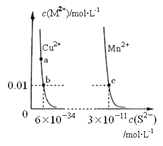
A. a���Ӧ��Ksp����b���Ӧ��Ksp
B. ��CuSO4��Һ�м���MnS�������·�Ӧ��Cu2+��aq��+MnS��s��=CuS��s��+Mn2+��aq��
C. �ں���CuS��MnS�������Һ��c��Cu2+����c��Mn2+��=2��10��23��1
D. ���¶��£�Ksp��CuS��С��Ksp��MnS��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л�������A����Է�������(������)����110��С��150����������֪������̼�������������֮��Ϊ52.24%������Ϊ������ش�
(1)�û���������к���___________����ԭ�ӡ�
(2)�û�����ķ���ʽΪ____________��
(3)�û������������ຬ______��̼��˫����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�����������������ȷ���ǣ� ��
A. ��״���£�1molFe�ֱ��������������ˮ������Ӧת�Ƶĵ�������Ϊ2NA
B. 11.2LH2�к��е�ԭ����ΪNA
C. Na2O��Na2O2�Ļ���ﹲ1mol����������ĿΪNA
D. 1.0L1mol/L��Na2SO4ˮ��Һ�к��е���ԭ����ĿΪ4NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1.0 mol/L������ε��뵽100 mL����NaOH��NaAlO2��Na2CO3�Ļ����Һ�У���Ӧ������ͼ��ʾ�������й�˵������ȷ����
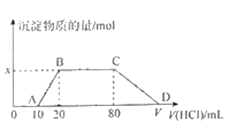
A. ���Һ��NaOH�����ʵ���Ũ��Ϊ0.1 mol/L
B. x��0.01
C. BC�εķ�Ӧ�������ӷ���ʽΪ��CO![]() ��H+ ====HCO
��H+ ====HCO
D. V��110
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��ȥ�����е�Ca2+. Mg2+. SO42-�Լ���ɳ�����ʣ�ijͬѧ�����һ���Ʊ����ε�ʵ�鷽�����������£����ڳ������Լ��Թ�����
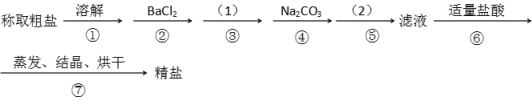
��1���ڢܲ��У�д����Ӧ�����ӷ���ʽ���������Һ��Ca2+����Ҫ������ʽΪCaCl2��_______________ ��____________��
��2��ʵ�鷽���ģ�1����Ӧʹ�ó����Լ��Ļ�ѧʽ__________�����������ӷ���ʽ��__________����ʵ�鷽���ģ�2���еIJ���������_______��
��3����ʵ����Ʒ����Ż��ĽǶȷ�������ںܿ͢ɷ�ߵ�____________����ǡ������������˵�����ɡ�___________________________________________��
��4���ж�BaCl2�ѹ����ķ�����_________________________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com