
【题目】设NA表示阿伏加德罗常数,下列叙述正确的是( )
A. 标准状况下,1molFe分别与足量的盐酸和水蒸气反应转移的电子数均为2NA
B. 11.2LH2中含有的原子数为NA
C. Na2O与Na2O2的混合物共1mol,阴离子数目为NA
D. 1.0L1mol/L的Na2SO4水溶液中含有的氧原子数目为4NA
【答案】C
【解析】
A. 铁与盐酸反应生成氯化亚铁和氢气, 1molFe与足量的盐酸反应转移的电子数为2NA,铁与水蒸气反应生成四氧化三铁和氢气, 1molFe与足量水蒸气反应转移的电子数为![]() NA,故A错误;
NA,故A错误;
B. 标准状况下11.2LH2中含有的原子数为NA,非标准状况下11.2LH2中含有的原子数不一定为NA,故B错误;
C. Na2O中阴离子是O2-、Na2O2中阴离子是O22-,1mol Na2O与Na2O2的混合物中阴离子数目为NA,故C正确;
D. Na2SO4、H2O都含有O原子,1.0L 1mol/L的Na2SO4水溶液中含有的氧原子数目大于4NA,故D错误;
答案选C。


 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
【题目】下图为CaF2、H3BO3(层状结构,层内的H3BO3分子通过氢键结合)、金属铜三种晶体的结构示意图,请回答下列问题:
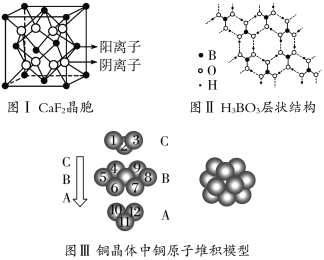
(1)图Ⅰ所示的CaF2晶体中与Ca2+最近且等距离的F-数为________,图Ⅲ中未标号的铜原子形成晶体后周围最紧邻的铜原子数为________。
(2)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是________,H3BO3晶体中B原子个数与极性键个数比为________。
(3)三种晶体中熔点最低的是________,其晶体受热熔化时,克服的微粒之间的相互作用为________________________________________________________________。
(4)结合CaF2晶体的晶胞示意图,已知,两个距离最近的Ca2+核间距离为a×10-8 cm,计算CaF2晶体的密度为________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,V L HCl溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρ g/mL,质量分数为w,物质的量浓度为c mol/L,则下列关系中不正确的( )
A.![]()
B.![]()
C.![]()
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2SO3溶液作为吸收液吸收SO2时,吸收液pH随n(SO32-)∶n(HSO3-)变化图像如图:
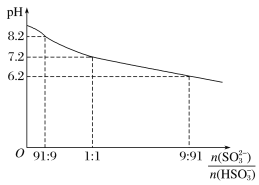
则以下离子浓度关系的判断正确的是
A. NaHSO3溶液中c(H+)<c(OH-)
B. Na2SO3溶液中c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
C. 当吸收溶液呈中性时,c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)=c(H+)
D. 当吸收溶液呈中性时,c(Na+)>c(HSO3-)+c(SO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生产和生活中有着重要的作用。下列有关说法不正确的是( )
A. 焊接金属时常用![]() 溶液做除锈剂
溶液做除锈剂
B. 嫦娥系列卫星中使用的碳纤维,是一种新型无机非金属材料
C. 只要符合限量,“食用色素”、“亚硝酸盐”可以作为某些食品的添加剂
D. PM2.5是指大气中直径小于或等于2.5微米的颗粒物,是发生雾霾天气的主要原因,这些颗粒物扩散在空气中都会形成胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A(g)+2B(g) ![]() 2C(g) ΔH=-Q kJ·mol-1(Q>0),在恒容的密闭容器中充入1 mol A和2 mol B,一定条件下发生反应。下列有关说法正确的是( )
2C(g) ΔH=-Q kJ·mol-1(Q>0),在恒容的密闭容器中充入1 mol A和2 mol B,一定条件下发生反应。下列有关说法正确的是( )
A. 平衡前,随着反应的进行,容器内气体密度逐渐减小
B. 平衡时,该反应放出的热量为Q kJ
C. 平衡后,再向容器中通入1 mol氦气,A的转化率增大
D. 平衡后,缩小容器容积,A的浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用“化学计量在实验中的应用”的相关知识填空。
(1)含有6.02×1023个氧原子的H2SO4的物质的量是___________。
(2)与标准状况下V LCO2所含氧原子数目相同的水的质量是___________g(用分式表示)
(3)设NA为阿伏加德罗常数的数值,如果a g氧气中含有的分子数为b,则c g氧气在标准状况下的体积约是________(用含NA的式子表示)。
(4)将4 g NaOH溶解在水中配成10 mL溶液,再稀释成1 L,从中取出10 mL,这10 mL溶液的物质的量浓度为_______。
(5)体积比为1∶2∶3的氯化钠、氯化镁和氯化铝溶液,分别加入等体积、等浓度的硝酸银溶液,均恰好完全反应生成氯化银沉淀,则这三种溶液的物质的量浓度之比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U形管的质量差,下列说法正确的是( )
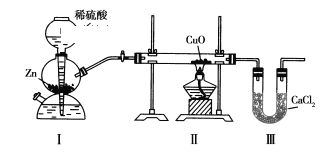
A. 若实验测得m(H):m(O)>1:8,则导致这一结果的原因可能为Ⅱ装置中的CuO没有全部被还原
B. Ⅰ、Ⅱ装置之间缺少干燥装置
C. 该实验的操作顺序为:先点燃酒精灯,然后将氢气通入Ⅱ装置
D. Ⅲ装置后是否加入干燥装置,均不会对实验结果带来影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验需要物质的量浓度为0.5mol/L的NaOH溶液960mL用于酸碱中和实验,配制NaOH溶液的步骤如下,回答下列问题:
第一步:称取NaOH固体,加入适量蒸馏水溶解;
第二步:待冷却后转移至容量瓶中;
第三步:用蒸馏水洗涤烧杯和玻璃棒2~3次,将洗涤液也注入容量瓶中;
第四步:定容
第五步:摇匀。
(1)第一步中称量NaOH固体的质量为____g;
(2)第四步“定容”的具体操作为____;
(3)如果配制溶液过程中出现下列情况会对所配制的溶液物质的量浓度有何影响?(填“偏大”、“偏小”或“无影响”)
①容量瓶中原有少量蒸馏水___,
②定容时俯视观察____,
③把烧碱放在纸上称量____,
④溶解所用的烧杯未洗涤____;
(4)取所配溶液10mL于试管中,加入5mL某浓度的盐酸溶液恰好中和,则所加的盐酸溶液的物质的量浓度是____mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com