
【题目】已知:A(g)+2B(g) ![]() 2C(g) ΔH=-Q kJ·mol-1(Q>0),在恒容的密闭容器中充入1 mol A和2 mol B,一定条件下发生反应。下列有关说法正确的是( )
2C(g) ΔH=-Q kJ·mol-1(Q>0),在恒容的密闭容器中充入1 mol A和2 mol B,一定条件下发生反应。下列有关说法正确的是( )
A. 平衡前,随着反应的进行,容器内气体密度逐渐减小
B. 平衡时,该反应放出的热量为Q kJ
C. 平衡后,再向容器中通入1 mol氦气,A的转化率增大
D. 平衡后,缩小容器容积,A的浓度增大
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知氯化铝的熔点为190℃(2.02×105Pa),但它在180℃即开始升华。
(1)氯化铝是________________(填“离子化合物”或“共价化合物”)。
(2)在500K和1.01×105Pa时,它的蒸气密度(换算成标准状况时)为11.92g·L-1,且已知它的结构中有配位键(当共价键中共用的电子对是由其中一原子独自供应,另一原子提供空轨道时,就形成配位键)。配位键形成后,就与一般共价键无异,氯化铝的化学式为________,结构式为________。
(3)无水氯化铝在空气中强烈地“发烟”,其原因是______________________。
(4)设计一个更可靠的实验,判别氯化铝是离子化合物还是共价化合物。你设计的实验是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需纯净的NaCl晶体,但现有的NaCl晶体中混有少量的Na2SO4和NH4HCO3,为除去杂质,甲同学设计了如下实验:(已知NH4HCO3 ![]() NH3↑+H2O+CO2↑)
NH3↑+H2O+CO2↑)
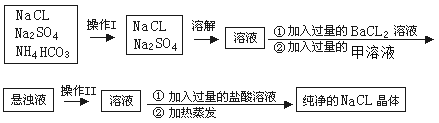
(1)上述操作I、II的名称分别为______、_______
(2)进行操作“加入过量的BaCl2溶液”时,如何判断BaCl2溶液已过量,其方法是______________________________________________________
(3)操作“加入过量的甲溶液”,甲溶液为______溶液,此操作的目的是________________________。
(4)操作“加入过量的盐酸溶液”的目的是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物A的相对分子质量(分子量)大于110,小于150。经分析得知,其中碳和氢的质量分数之和为52.24%,其余为氧。请回答:
(1)该化合物分子中含有___________个氧原子。
(2)该化合物的分子式为____________。
(3)该化合物分子中最多含______个碳氧双键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述正确的是( )
A. 标准状况下,1molFe分别与足量的盐酸和水蒸气反应转移的电子数均为2NA
B. 11.2LH2中含有的原子数为NA
C. Na2O与Na2O2的混合物共1mol,阴离子数目为NA
D. 1.0L1mol/L的Na2SO4水溶液中含有的氧原子数目为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把aL含硫酸铵和硝酸铵的混合液分成2等份,一份需用bmol烧碱刚好把铵全部反应,另一份与氯化钡溶液反应时,消耗cmol氯化钡。由此可知原溶液中NO3-离子的物质的量浓度为(单位:mol·L-1)
A.![]() mol/LB.
mol/LB.![]() mol/L
mol/L
C.![]() mol/LD.
mol/LD.![]() mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.0 mol/L盐酸逐滴滴入到100 mL含有NaOH、NaAlO2和Na2CO3的混合溶液中,反应过程如图所示。下列有关说法不正确的是
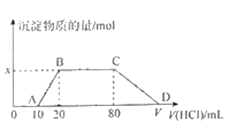
A. 混合液中NaOH的物质的量浓度为0.1 mol/L
B. x=0.01
C. BC段的反应过程离子方程式为:CO![]() +H+ ====HCO
+H+ ====HCO
D. V=110
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同体积、相同pH的氨水和氢氧化钠溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
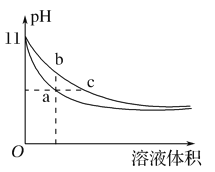
A. a点导电能力比b点强
B. b点的Kw值大于c点
C. 与盐酸完全反应时,消耗盐酸体积Va>Vc
D. a、c两点的c(H+)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和氮的化合物在生产生活中广泛存在。回答下列问题:
(1)三氯化氮(NCl3)是一种黄色、油状、具有刺激性气味的挥发性有毒液体,其原子均满足8e—结构。写出其电子式_____________________。氯碱工业生产时,由于食盐水中通常含有少量NH4Cl,而在阴极区与生成的氯气反应产生少量三氯化氮,该反应的化学方程式为______________。
(2)已知:2CO2(g) + 3NaOH(aq)=NaHCO3(aq)+Na2CO3(aq)+H2O(l) △H=-4a kJ/mol
CO2(g) +2NaOH(aq)=Na2CO3(aq)+H2O(l) △H=-b kJ/mol
该条件下CO2与NaOH溶液反应生成NaHCO3的热化学反应方程式为:____________。
(3)利用CO可以将NO转化为无害的N2,其反应为:2NO(g)+2CO(g)![]() N2(g)+2CO2(g),向容积均为IL的甲、乙、丙三个恒温(反应温度分别为300℃、T℃、300℃)容器中分别加入相同量NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
N2(g)+2CO2(g),向容积均为IL的甲、乙、丙三个恒温(反应温度分别为300℃、T℃、300℃)容器中分别加入相同量NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(CO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(CO)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
n(CO)(丙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
①甲容器中,0~40min内用NO的浓度变化表示的平均反应速率v(NO)=_______。
②该反应的△H______0(填“>”或“<”)。
③甲、丙容器达到平衡时,CO的转化率为α(甲)________α(乙)(填“>”,“< ”,“=”)
(4)常温下,在(NH4)2C2O4溶液中,反应NH4++C2O42—+H2O![]() NH3·H2O+HC2O4—的平衡常数K=___。(已知常温下,H2C2O4的电离平衡常数Ka1≈5×10-2,Ka2≈5×10-5 H2O的电离平衡常数Kw=1×10-14 NH3·H2O的电离平衡常数Kb≈2×10-5)
NH3·H2O+HC2O4—的平衡常数K=___。(已知常温下,H2C2O4的电离平衡常数Ka1≈5×10-2,Ka2≈5×10-5 H2O的电离平衡常数Kw=1×10-14 NH3·H2O的电离平衡常数Kb≈2×10-5)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com