
【题目】在体积为2L密闭容器中加入反应物A,B,发生如下反应:A(g)+2B(g)3C(g),该反应为放热反应.经2min后,A的浓度从开始时的1.0 molL﹣1降到0.8 molL﹣1 . 已知反应开始时B的浓度是1.2 molL﹣1 . 则2min末B的浓度为 , C的物质的量为 . 2min内,用A物质的浓度变化来表示该反应的反应速率,即v(A)= . 当反应达到平衡后,降低温度,平衡将 , 若通入0.5L氩气,平衡将 . (填“向右移动”、“向左移动”“不移动”)
【答案】0.8mol/L;1.2mol;0.1mol/(L?min);向右移动;不移动
【解析】解:2min内△c(A)=1mol/L﹣0.8mol/L=0.2mol/L, 浓度变化量之比等于化学计量数之比,则△c(B)=2△c(A)=2×0.2mol/L=0.4mol/L,则2min末B的浓度=1.2mol/L﹣0.4mol/L=0.8mol/L;
浓度变化量之比等于化学计量数之比,则△c(C)=3△c(A)=3×0.2mol/L=0.6mol/L,则2min末C的物质的量=0.6mol/L×2L=1.2mol;
2min内,用A物质的浓度变化来表示该反应的反应速率,v(A)= ![]() =0.1mol/(Lmin);
=0.1mol/(Lmin);
该反应为放热反应,反应达到平衡后降低温度,平衡向着放热的正反应移动,即平衡向右移动;
若通入0.5L氩气,容器容积不变,则各组分的浓度不变,平衡不移动,
所以答案是:0.8mol/L;1.2mol;0.1mol/(Lmin);向右移动;不移动.
【考点精析】利用化学平衡的计算对题目进行判断即可得到答案,需要熟知反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】向两份完全相同Ba(OH)2溶液中分别加入浓度相同的Al2(SO4)3和KAl(SO4)2溶液,产生的沉淀的物质的量随所加溶液体积关系如图。下列分析不正确的是
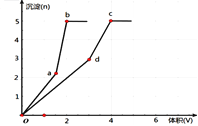
A. a、d两点的沉淀为BaSO4
B. b、c两点溶液的导电能力相同
C. b、c两点溶液的PH值相同
D. d点溶液中大量存在的阳离子是K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅及其化合物的叙述正确的是
A. 陶瓷、玻璃、水泥都是硅酸盐产品
B. 硅晶体可用于制造光导纤维
C. 二氧化硅在电子工业中是重要的半导体材料
D. 二氧化硅与氢氟酸和氢氧化钠均能反应,属于两性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向两个体积可变的密闭容器中均充入1mol的A 和2 mol 的B,发生反应:A2(g)+2B2(g)![]() 2AB2(g) △H。维持两个容器的压强分别为p1和p2,在不同温度下达到平衡,测得平衡时AB2的体积分数随温度的变化如图所示。
2AB2(g) △H。维持两个容器的压强分别为p1和p2,在不同温度下达到平衡,测得平衡时AB2的体积分数随温度的变化如图所示。
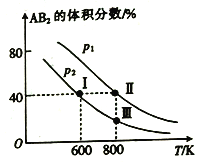
已知: ①图中I、Ⅱ、Ⅲ点均处于曲线上;②点Ⅱ时容器的体积为0.1L。下列叙述正确的是
A. 由图像可知:p1>p2 △H<0
B. 点I时A2的平衡转化率为40%
C. 点Ⅲ所对应的反应平衡常数K=0.2
D. 将点Ⅱ所对应的容器冷却到600 K,可变成点I
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验兴趣小组用如下两种方法制取氮气。

已知:活性炭可用于吸附水中的絮状沉淀。
(1)方法一所发生反应的化学方程式为_________________。
(2)检验方法一反应后所得溶液中是否含有NH4+的实验方法是_________________。
(3)方法二被冰水冷却的U 型管中所得物质是_________________,用冰水冷却的目的是_________________。
(4)方法一与方法二相比所具有的优点是_________________。
(5)方法一和方法二中均需用到NH4Cl,NH4Cl的溶解度随温度变化的曲线如右图所示,工业NH4Cl固体中含有少量的FeCl2,可通过如下实验来提纯:将工业NH4Cl固体溶于水,_________,调节溶液的pH为4~5,向溶液中加入活性炭,将溶液加热浓缩,________获得纯净的NH4Cl固体。(实验中可供选择的试剂有:双氧水、KMnO4溶液)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去空气中的二氧化硫和氨氧化物气体对环境保护有重要意义。
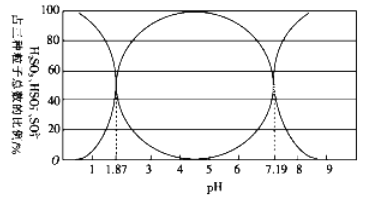
(1)二氧化硫易溶于水,溶于水后所得溶液中H2SO3、HSO3-和SO32- 占三种粒子总数的比例随pH的变化如下图所示。由图可知H2SO3 的电离平衡常数Ka1=____________。
(2)利用尿素[CO(NH2)2]水解的溶液可以吸收含SO2 的空气。已知尿素水解放热,常温下水解反应较慢,水解的反应方程式如下:CO(NH2)2+H2O=H2NCOONH4(氨基甲酸铵)。
①氨基甲酸铵会与空气中的SO2 和O2 反应生成(NH4)2SO4,该反应的化学方程式为__________。
②一定条件下,用尿素溶液吸收含SO2 的空气,测得SO2 的吸收率随溶液的温度变化如图甲所示。温度高于60 ℃时,SO2 的吸收率逐渐升高的原因是_____________。
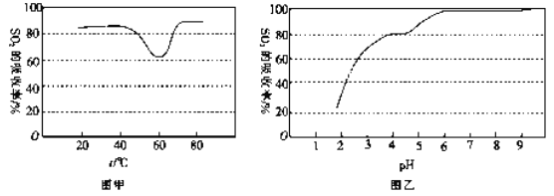
③尿素溶液吸收SO2 的吸收率随溶液的pH变化如图乙所示。尿素溶液吸收含SO2的空气后溶液的pH会降低,为提高SO2 的吸收率和充分回收产物,最好向溶液中加入_____(填溶液的名称)并控制pH 为_______。
(3)一种电化学脱硝法的原理如图所示。
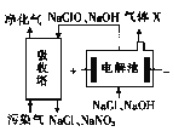
①电解池阴极所发生的电极反应为_____________。
②相同条件下通入的污染气和生成的X 的体积比为40 :3,污染气中NO 和NO2 占总体积的10%,若NaClO完全反应,污染气中NO和NO2 被完全吸收且其余气体不参与反应,则NO和NO2 的体积比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A.其他条件一定时,平衡常数发生变化,化学平衡必定发生移动
B.某特定反应的平衡常数仅是温度的函数
C.通常情况下,一个放热且熵增的反应也有可能非自发进行
D.需要加热或点燃才能进行的反应不一定是非自发反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以锂辉石为原料生产碳酸锂的部分工业流程如下:

已知:
①锂辉石的主要成分为Li2O·Al2O3·4SiO2,其中含少量Ca、Mg元素。
②Li2O·Al2O3·4SiO2 + H2SO4(浓) ![]() Li2SO4 + Al2O3·4SiO2·H2O
Li2SO4 + Al2O3·4SiO2·H2O
③某些物质的溶解度(s)如下表所示。
T/℃ | 20 | 40 | 60 | 80 |
s(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
s(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
(1)从滤渣Ⅰ中分离出Al2O3的流程如下图所示。请写出生成沉淀的离子方程式______。
![]()
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述)________________________________________________。
(3)最后一个步骤中,用“热水洗涤”的原因是______________________________。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液做阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入少量NH4HCO3溶液并共热,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是_________________________
②电解后,LiOH溶液浓度增大的原因_________________,b中生成Li2CO3反应的化学方程式是___________________________________________。
(5)磷酸亚铁锂电池总反应为:FePO4+Li![]() LiFePO4,电池中的固体电解质可传导Li+,试写出该电池放电时的正极反应:__________________。
LiFePO4,电池中的固体电解质可传导Li+,试写出该电池放电时的正极反应:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某课外活动小组为了检验浓硫酸与木炭在加热条件下反应产生的SO2和CO2气体,设计了如图1所示实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用I2和淀粉的蓝色溶液浸湿的脱脂棉.
请回答下列问题
(1)对于易燃、易爆、有毒的化学物质,往往会在其包装上面贴上危险警告标签如图2.浓硫酸的危险警告标签是 .
(2)装置A中发生反应的化学方程式为 .
(3)此实验成败的关键在于控制反应产生气体的速率不能过快,因此设计了虚框部分的装置,则正确的操作顺序是(用操作编号填写)
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水夹b;
(4)实验时,装置C中的现象为;
(5)当D中产生现象时,可以说明使E中澄清石灰水变浑浊的是CO2 , 而不是SO2;写出D中发生反应的化学方程式,并标出电子转移方向和数目 .
(6)Ⅱ. Cu与浓硫酸反应可得硫酸铜溶液.某学习小组将铜屑放入一定浓度的硫酸中,加热并不断鼓入空气也可得硫酸铜溶液,其反应原理为2Cu+O2+2H2SO4═2CuSO4+2H2O.现欲将12.8g铜完全溶解,加蒸馏水后得200mL溶液.计算:
参加反应的氧气在标准状况下的体积是L.(不必写计算过程)
(7)所得硫酸铜溶液的物质的量浓度是mol/L(不必写计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com