
| 粒子代号 | A | B | C | D | E | F | G |
| 原子核数 | 单核 | 单核 | 双核 | 4核 | 单核 | 多核 | 多核 |
| 电荷数 | 0 | 1+ | 1— | 0 | 2+ | 1+ | 0 |

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源:不详 题型:填空题
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 一 | ① | | ||||||
| 二 | | | | ② | ③ | ④ | | |
| 三 | ⑤ | | ⑥ | ⑦ | | ⑧ | | |
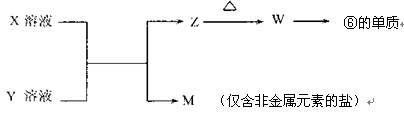
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.X元素能形成+7价的含氧酸及其盐 |
| B.Y元素原子最外层电子数为2 |
| C.Z元素的阴离子与同一周期稀有气体元素的原子电子层结构相同 |
| D.R元素的最高价氧化物是酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.熔点由高到低SiO2>CsCl>CBr4>CF4 | B.热稳定性:HF>H2S>H2O |
| C.离子半径:O2->Na+>Mg2+ | D.酸性:HClO4>H2SO4>H3PO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.ⅢA族的B和Al都能形成+3价的化合物 |
| B.ⅣA族的C和Si都能形成+4价的化合物 |
| C.ⅤA族的N和P都能形成+5价的化合物 |
| D.ⅥA族的O和S都能形成+6价的化合物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 元素代号 | L | M | X | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | ﹢2 | ﹢3 | ﹢6、﹣2 | ﹢2 | ﹣2 |
| A.离子半径大小:r(M3﹢)>r(T2﹣) | B.R的氧化物对应的水化物可能具有两性 |
| C.X单质可在氧气中燃烧生成XO3 | D.L、X形成的简单离子核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com