
【题目】铁是人类较早使用的金属之一。运用铁及其化合物的有关知识,回答下列问题:
(1)铁和铁合金是生活中的常用材料,下列叙述中,正确的是________。
A.纯铁硬度比生铁高 B.纯铁耐腐蚀性强,不易生锈
C.不锈钢是铁合金,只含金属元素 D.铁在一定条件下,可与水蒸气反应
E.铁在冷的浓硫酸中钝化
(2)向沸水中逐滴滴加1 mol·L-1 FeCl3溶液,至液体呈透明的红褐色,该反应的离子方程式为______________________________________________________
形成该分散系的微粒直径范围是_________________________________。
(3)电子工业需用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。请写出 FeCl3溶液与铜反应的离子方程式________________________________________________。
欲从腐蚀后的废液中回收铜并重新获得FeCl3溶液,现有下列试剂:①氯气,②铁粉,③浓硝酸,④浓盐酸,⑤烧碱,⑥浓氨水,需要用到的一组试剂是________。
A.①②④ B.①③④⑥ C.②④⑤ D.①④⑥
(4)高铁酸钠Na2FeO4 是一种新型净水剂。
①高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH===2Na2FeO4+3X+5H2O,则X的化学式为____________。
②下列物质能作水处理剂的有________。
A.KAl(SO4)2·12H2O B.[Fe(OH)(SO4)]n C.ClO2 D.“84”消毒液
③请写出向酸化的FeCl2溶液中滴加双氧水的离子方程式__________________。
【答案】BDE Fe3++3H2O=Fe(OH)3(胶体)+3H+ 1~100 nm 2Fe3++Cu===2Fe2++Cu2+ A NaCl ABC 2Fe2++H2O2+2H+=2Fe3++2H2O
【解析】
(1)A.合金的硬度比各成分金属的大,故A错误;B.纯铁不能形成原电池,生铁含碳量高,容易形成原电池,腐蚀速率快,故B正确;C.不锈钢含有的金元素有铁、镍、钼、钛、铌、铜、氮等,故错误;D.铁与水蒸气在高温下反应生成四氧化三铁和氢气,故D正确;E.浓硫酸具有强的氧化性,冷的浓硫酸与铁发生钝化反应,故E正确;故选BDE;
(2)氢氧化铁胶体制备的离子方程式为:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+,氢氧化铁胶体的微粒直径范围是1-100nm;
Fe(OH)3(胶体)+3H+,氢氧化铁胶体的微粒直径范围是1-100nm;
(3)FeC13溶液与铜反应生成氯化亚铁了氯化铜,离子方程式:2Fe3++Cu═2Fe2++Cu2+;腐蚀废液中含有氯化铜、氯化亚铁以及氯化铁,加入过量的铁可以和氯化铁反应生成氯化亚铁,和氯化铜反应生成金属铜和氯化亚铁,即Fe+Cu2+=Fe2++Cu、Fe+2Fe3+=3Fe2+,过滤,所得的滤液是氯化亚铁,滤渣是金属铜和过量的铁,铜不能盐酸反应,而金属铁可以,Fe+2H+=Fe2++H2↑,向滤渣中加入足量的盐酸可以将铜分离,再过滤,得到的滤液是氯化亚铁,氯气具有氧化性,能将亚铁离子氧化为三价铁,2Fe2++Cl2=2Fe3++2Cl-,再向滤液中通入氯气即可,故答案为A;
(4)①因为反应前后各元素原子个数相等,X的化学式为NaCl;
②KAl(SO4)212H2O 电离生成的铝离子水解生成的氢氧化铝、聚合硫酸铁[Fe(OH)(SO4)]n,都能够吸附水中的杂质颗粒,可以用作净水剂;C.ClO2有强氧化性,可以杀菌消毒,危害也小,因此可以处理水,D.“84”消毒液有杀菌消毒作用,但是碱性太强,错误。故答案为ABC。
③向酸化的FeCl2溶液中滴加双氧水发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O。


科目:高中化学 来源: 题型:
【题目】如图是在明矾溶液中滴入氢氧化钡溶液,下列说法错误的是( )

A. OA段的反应离子方程式为:2Al3++3SO![]() +3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
B. AB段的离子方程式只有:Al(OH)3+OH-===AlO![]() +2H2O
+2H2O
C. A点的沉淀为Al(OH)3和BaSO4的混合物
D. B点溶液为KAlO2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有如下离子:H+、Mg2+、Al3+、NH4+、Cl-、AlO2-。当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )

A. 原溶液中一定含有的阳离子是H+、Mg2+、Al3+、NH4+
B. 反应最后形成的溶液中的溶质含AlCl3
C. 原溶液中Al3+与NH的物质的量之比为1∶3
D. 原溶液中含有的阴离子是Cl-、AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应过程中体系的能量变化如图所示,下列说法错误的是
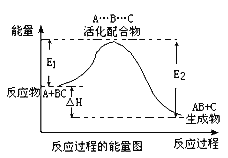
A. 该反应不一定能自发进行
B. E1为反应物的平均能量与过渡态的能量差,称为正反应的活化能
C. 正反应的热效应为△H=E1-E2,且E2>E1,所以正反应为放热反应
D. 加入合适催化剂,△H不变,E1、E2也不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有0.2mol某有机物和0.5mol氧气在一密闭容器中燃烧得产物为CO2、CO、H2O(气)。产物依次通过浓硫酸时,浓硫酸的质量增加了 10.8g;再通过灼热的氧化铜时,氧化铜的质量减轻了 3.2g;又通过碱石灰时,碱石灰的质量增加了17.6g。该有机物的化学式是( )
A. C2H4 B. C2H6O2 C. C2H6O D. C3H6O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中放入4molN2O5,发生如下反应:2N2O5(g)![]() 4NO2(g)+ O2(g)。反应5min后,测得N2O5转化了20%,求:
4NO2(g)+ O2(g)。反应5min后,测得N2O5转化了20%,求:
(1)υ(NO2)、υ(O2)分别为多少?
(2)5min时,N2O5占混合气体总体积的百分比是多少?
(要求写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.氯化钠可用于生产金属钠和氯气
B.铁的冶炼和普通玻璃的生产都要用到石灰石
C.SO2和CO2都是“城市空气质量日报”的报道内容
D.石墨质软、能导电,常用作润滑剂和电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)分子式为C5H10、核磁共振氢谱中只有一个峰的烃的结构简式_______;
(2)①分子式为C7H8的芳香烃与浓硝酸反应的化学方程式____________________________,②环己烯与溴的四氯化碳溶液反应的化学方程式_________________________________;
(3)用系统命名法命名
①![]() 名称:_________________。
名称:_________________。
② 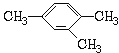 名称:_________________。
名称:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,向某VL的密闭容器中充入3molH2(g)和3molI2(g),发生反应:H2(g)+I2(g)![]() 2HI(g) △H=-26.5kJmol-1,测得各物质的物质的量浓度与时间变化的关系如图所示。请回答下列问题:
2HI(g) △H=-26.5kJmol-1,测得各物质的物质的量浓度与时间变化的关系如图所示。请回答下列问题:

(1)0-5秒内平均反应速率v(HI)=___mol/(Ls)。
(2)该反应达到平衡状态时,放出的热量为___kJ。
(3)判断该反应达到平衡的依据是___(填序号)。
①H2消耗的速率和I2消耗的速率相等
②H2、I2、HI的浓度比为1:1:2
③H2、I2、HI的浓度都不再发生变化
④该条件下正、逆反应速率都为零
⑤混合气体的平均分子量不再发生变化
⑥气体的颜色不再发生变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com