
【题目】镓(Ga)位于周期表的第四周期,与Al同主族,主要存在Ga3+、GaO2-两种离子形态,被广泛应用于电子工业。
(1)Ga的原子序数为______。
(2)半导体材料氮化稼是由Ga与NH3在一定条件下合成的,该过程中每生成3molH2时,就会放出30.8kJ的热量。
①反应的热化学方程式是________。
②反应的化学平衡翻常数表决达式是_________________。
③在恒温恒容的密闭体系内进行上述可逆反应,下列有关表达正确的是_____(填字母代号).

A.Ⅰ图象中如果纵坐标为正反应速率,则t时刻改变的条件可以为升温或加压
B.Ⅱ图象中纵坐标可以为稼的转化率
C.Ⅲ图象中纵坐标可以为化学反应速率
D.Ⅳ图象中纵坐标可以为体系内混合气体的平均相对分子质量
(3)工业上多用电解精炼法提纯稼。具体原理如下图所示:

已知:金属的活动性Zn>Ga>Fe>Cu
①X为电源的_____极,电解精炼稼时阳极泥的成分是__________;
②在电解过程中使某种离子迁移到达阴极并在阴极放电析出高纯稼, 请写出该电解过程中的电极反应方程式:阳极_________;阴极_________。
【答案】 31 2Ga(s)+ 2NH3(g)![]() 2GaN(s)+3H2(g) △H=-30.8kJ/mol
2GaN(s)+3H2(g) △H=-30.8kJ/mol 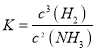 A 正 Fe和Cu Ga-3e-+4OH-=GaO2-+2H2O GaO2-+3e-+2H2O=Ga+4OH-
A 正 Fe和Cu Ga-3e-+4OH-=GaO2-+2H2O GaO2-+3e-+2H2O=Ga+4OH-
【解析】镓(Ga)位于周期表的第四周期,与Al同主族,主要存在Ga3+、GaO2-两种离子形态,被广泛应用于电子工业。
(1)镓(Ga)位于周期表的第四周期,与Al同主族,Ga的原子序数为13+18=31。(2)半导体材料氮化稼是由Ga与NH3在一定条件下合成的,该过程中。
①每生成3molH2时,就会放出30.8kJ的热量,因此反应的热化学方程式是2Ga(s)+ 2NH3(g)![]() 2GaN(s)+3H2(g) △H=-30.8kJ/mol。②根据方程式可知反应的化学平衡翻常数表决达式K=
2GaN(s)+3H2(g) △H=-30.8kJ/mol。②根据方程式可知反应的化学平衡翻常数表决达式K=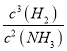 。③A.Ⅰ图象中如果纵坐标为正反应速率,正反应是放热的、体积增大的可逆反应,升高温度或增大压强平衡均向逆反应方向进行,A正确;B.增大压强平衡向逆反应方向进行,转化率降低,B错误;C.改变固体质量反应速率不变,C错误;D.升高温度或增大压强平衡均向逆反应方向进行,混合气体的平均相对分子质量增大,D错误,答案选A。(3)①X电极是粗Ga,是阳极,则X为电源的正极,金属的活动性Zn>Ga>Fe>Cu,所以铁和铜不会生气电子,则电解精炼稼时阳极泥的成分是 Fe和Cu;②在电解过程中使某种离子迁移到达阴极并在阴极放电析出高纯稼,由于溶液显碱性,因此该离子是GaO2-,电解过程中的电极反应方程式为阳极:Ga-3e-+4OH-=GaO2-+2H2O;阴极:GaO2-+3e-+2H2O=Ga+4OH-。
。③A.Ⅰ图象中如果纵坐标为正反应速率,正反应是放热的、体积增大的可逆反应,升高温度或增大压强平衡均向逆反应方向进行,A正确;B.增大压强平衡向逆反应方向进行,转化率降低,B错误;C.改变固体质量反应速率不变,C错误;D.升高温度或增大压强平衡均向逆反应方向进行,混合气体的平均相对分子质量增大,D错误,答案选A。(3)①X电极是粗Ga,是阳极,则X为电源的正极,金属的活动性Zn>Ga>Fe>Cu,所以铁和铜不会生气电子,则电解精炼稼时阳极泥的成分是 Fe和Cu;②在电解过程中使某种离子迁移到达阴极并在阴极放电析出高纯稼,由于溶液显碱性,因此该离子是GaO2-,电解过程中的电极反应方程式为阳极:Ga-3e-+4OH-=GaO2-+2H2O;阴极:GaO2-+3e-+2H2O=Ga+4OH-。


科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12。某溶液中含有Cl-,Br-,CrO4-,浓度均为0.010mol/L,向该溶液中逐滴加入0.010mol/L的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
A. Cl-、Br-、CrO4- B. Br-、Cl-、CrO4- C. CrO4-、Br-、Cl- D. Br-、CrO4-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】⑴下列五种物质中,①Ar ②CO2 ③NaOH ④K2S ⑤NH4Cl ⑥SiO2,只存在共价键的是__________,(填序号,下同)只存在离子键的是__________,既存在离子键又存在共价键的是___________,不存在化学键的是___________。
⑵ W、X、Y、Z均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、6、8、8,它们的最外层电子数之和为15, W和Y的最外层电子数相同。则 ① Y、Z两元素的名称分别为______、_______。
② W2X2 的电子式为____________ ③Y2X2中存在的化学键是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 钠和水反应:Na+H2O==Na++OH-+H2↑
B. 盐酸与氢氧化钠溶液反应:H++OH-==H2O
C. 三氯化铁腐蚀印刷线路板:Fe3++Cu==Fe2++Cu2+
D. 醋酸与碳酸钠反应制备二氧化碳:CO32-+2H+==CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两个体积相同的容器,一个盛有一氧化氮,另一个盛有氮气和氧气,在同温同压下两容器内的气体一定具有相同的( )
A.电子总数
B.原子总数
C.质量
D.质子总数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸苯甲酯可用作茉莉、白兰、月下香等香精的调合香料。它可以用甲苯和乙烯为原料进行人工合成。合成路线如下:
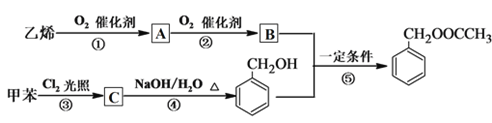
已知:R—Cl![]() R—OH
R—OH
(1)写出以下反应类型:反应②______________、反应⑤____________。
(2)写出以下反应的化学方程式:
反应①_________________________,反应③________________________。
(3)甲苯的一氯代物有________种。
(4)反应③可能生成的副产物为___________(写一种)。
(5)请设计合理方案从![]() 合成
合成 。已知:①CH3CH=CH2
。已知:①CH3CH=CH2![]() CH3CH2CH2Br;②CH3CH2Br
CH3CH2CH2Br;②CH3CH2Br![]() CH3CH2OH
CH3CH2OH
提示:①合成过程中无机试剂任选;
②合成路线流程图示例如下:CH3CH2OH![]() CH2=CH2
CH2=CH2![]() BrCH2CH2Br
BrCH2CH2Br
_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.含有氧元素的化合物都是氧化物
B.同种分子构成的物质一定是纯净物
C.非金属氧化物都是酸性氧化物
D.BaSO4在水溶液中难导电.所以BaSO4是非电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com