
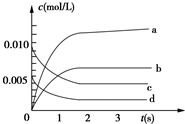
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
分析 (1)c(NO)=$\frac{n(NO)}{V}$.
(2)v=$\frac{△c}{△t}$.
(3)化学平衡状态的判断:正反应速率与逆反应速率相等.对于气体体积变化的可逆反应,当密闭容器中压强不变时,反应达到平衡状态.
(4)增大反应速率的方法:适当提高反应温度,增大反应物浓度,选择高效催化剂.
解答 解:(1)平衡时n(NO)=0.007mol,容器体积2L,所以c(NO)=$\frac{n(NO)}{V}$=$\frac{0.007mol}{2L}$=0.0035mol/L,
故答案为:0.0035mol/L;
(2)根据一氧化氮物质的量的变化知,该反应向正反应方向移动,则二氧化氮的物质的量在不断增大,且同一时间段内,一氧化氮减少的物质的量等于二氧化氮增加的物质的量,所以表示NO2的变化的曲线是b,0~2s内v(NO)=$\frac{\frac{0.020-0.008}{2}}{2}$ mol/(L.s)=0.0030mol/(L.s),同一化学反应同一时间段内,各物质的反应速率之比等于其计量数之比,所以氧气的反应速率为 0.0015mol/(L•s)
故答案为:b;1.5×10-3 mol/(L•s);
(3)a、无论反应是否达到平衡状态,v(NO2)=2v(O2)始终存在,故a错误;
b、该反应是气体体积变化的反应,所以该反应 受压强的影响,只要压强不再变化,反应就达平衡状态,故b正确;
c、v正(NO)=2v逆(O2),正逆反应符合系数比,故c正确;
d、根据质量守恒,反应前后质量不变,容器的体积不变,所以密度始终不变,故d错误;
故答案为:b、c;
(4)a.增大体积,浓度降低,化学反应速率减小,故a错误;
b.升高温度,化学反应速率加快,故b正确;
c.增大O2的浓度,化学反应速率加快,故c正确;
d.选择高效的正催化剂,可以加快反应速率,故d正确;
故答案为:bcd.
点评 本题主要考察化学反应速率、化学平衡以及影响速率和平衡的因素,综合性较强.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙烯与苯都能使溴水褪色,但褪色原理不同 | |
| B. | 1 mol乙烯与Cl2完全加成,然后与Cl2发生取代反应,共消耗氯气5mol | |
| C. | 溴水遇到乙醛溶液出现褪色现象,是因为它们发生了氧化反应 | |
| D. | 二氯甲烷存在两种不同的结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用敞口容器称量NaOH且时间过长 | |
| B. | 定容时俯视读取刻度 | |
| C. | 原容量瓶洗净后未干燥 | |
| D. | 配制过程中,未用蒸馏水洗涤烧杯和玻璃棒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
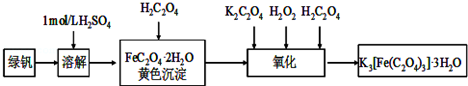
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
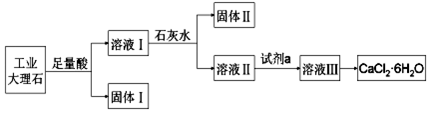
| A. | 固体Ⅰ中含有SiO2 | |
| B. | 使用石灰水时,要控制pH,防止固体Ⅱ中Al(OH)3转化为[Al(OH)4]- | |
| C. | 试剂a选用盐酸,从溶液Ⅲ得到CaCl2•6H2O的过程中,须控制条件防止其分解 | |
| D. | 若改变实验方案,在溶液Ⅰ中直接加氨水至沉淀完全,滤去沉淀,其溶液经蒸发浓缩、冷却结晶也可得到纯净CaCl2•6H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com