
【题目】已知空气—锌电池的电极反应为
锌片:Zn+2OH2e===ZnO+H2O;
碳棒:O2+2H2O+4e===4OH,据此判断,锌片是
A. 正极,被还原B. 正极,被氧化C. 负极,被还原D. 负极,被氧化
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)2NO2(g)△H=+57kJmol﹣1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示.下列说法正确的是

A. A、C两点的反应速率:A>C
B. A、C两点气体的颜色:A深,C浅
C. A、B两点气体的平均相对分子质量:A>B
D. B、C两点化学平衡常数:B<C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D 4种元素的原子序数均小于18,其最高正价依次为+1、+4、+5、+7,已知B的原子核外次外层电子数为2。A、C原子的核外次外层电子数为8。D元素的最高价氧化物对应水化物是已知无机含氧酸中最强的酸。则:
(1)A、B、C、D分别是______、______、________、________。
(2)A的离子结构示意图为__________,C的原子结构示意图为__________。
(3)C的最高价氧化物对应水化物与A的氢氧化物反应生成____种盐,其化学式分别为____、_____、_____(可不填满,也可补充)。
(4)C、D的气态氢化物稳定性由强到弱的顺序是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
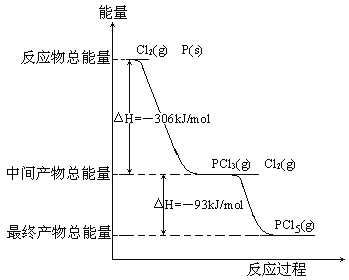
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式_________________________________。
(2)PCl5分解成PCl3和Cl2的热化学方程式_________________________________,上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.80molPCl5,反应达到平衡时PCl5还剩0.60mol,其分解率α1等于_________;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2_______α1(填“大于”、“小于”或“等于”)。
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是________________________________________。
(4)P和Cl2分两步反应生成1molPCl5的△H3=_________,P和Cl2一步反应生成1molPCl5的△H4______△H3(填“大于”、“小于”或“等于”)。
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸正丁酯是一种优良的有机溶剂,广泛用于硝化纤维清漆中,在人造革、织物及塑料加工过程中用作溶剂,也用于香料工业。某化学兴趣小组在实验室用乙酸和正丁醇制备乙酸正丁酯,有关物质的相关数据及实验装置如下所示:
化合物 | 相对分子质量 | 密度(g/cm3) | 沸点(℃) | 溶解度(g/100 g水) |
冰醋酸 | 60 | 1.045 | 117.9 | 互溶 |
正丁醇 | 74 | 0.80 | 118.0 | 9 |
乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
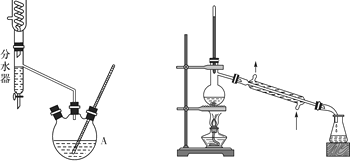
I II
分水器的操作方法:先将分水器装满水(水位与支管口相平),再打开活塞,准确放出一定体积的水。在制备过程中,随着加热回流,蒸发后冷凝下来的有机液体和水在分水器中滞留分层,水并到下层(反应前加入的)水中;有机层从上面溢出,流回反应容器。当水层增至支管口时,停止反应。
乙酸正丁酯合成和提纯步骤为:
第—步:取18.5 mL正丁醇和15.4 mL冰醋酸混合加热发生酯化反应,反应装置如图Ⅰ所示(加热仪器已省略);
第二步:依次用水、饱和Na2CO3溶液、水对烧瓶中的产品洗涤并干燥;
第三步:用装置Ⅱ蒸馏提纯。
请回答有关问题:
(1)第一步装置中除了加正丁醇和冰醋酸外,还需加入___________、______________。
(2)实验中使用分水器的优点有________________、 ___________。根据题中给出的相关数据计算,理论上,应该从分水器中放出来的水的体积约为___________。
(3)第二步用饱和Na2CO3溶液洗涤的目的是____________________________。
(4)第三步蒸馏产品时,应收集温度在_______________左右的馏分。若实验中得到乙酸正丁酯12.76 g,则乙酸正丁酯的产率为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)和亚硫酰氯(SOCl2)常用作氯化剂,都可用于医药、农药、染料工业及有机合成工业。亚硫酰氯还用于制锂亚硫酰氯(Li/SOCl2)电池。
有关物质的部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
SO2Cl2 | -54.1 | 69.1 | ①易水解,产生大量白雾 ②易分解:SO2Cl2 |
H2SO4 | 10.4 | 338 | 具有吸水性且难分解 |
实验室用干燥而纯净的二氧化硫和氯气合成硫酰氯,反应的热化学方程式为:SO2(g)+Cl2(g) ![]() SO2Cl2(l) △H= - 97.3 kJ·mol-1。反应装置如图所示(夹持仪器已省略),请回答有关问题:
SO2Cl2(l) △H= - 97.3 kJ·mol-1。反应装置如图所示(夹持仪器已省略),请回答有关问题:

(1)仪器A的名称为___________;
(2)仪器B的作用是_____________________;
(3)装置丙中盛放的试剂为____________,在实验室用氢氧化钠吸收多余硫酰氯反应的离子方程式为___________________;
(4)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有_________(填序号)
①先通冷凝水,再通气体 ②控制气流速率,宜慢不宜快
③若三颈烧瓶发烫,可适当降温 ④加热三颈烧瓶
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H=H2SO4+SO2Cl2,此方法得到的产品中会混有硫酸。
①从分解产物中分离出硫酰氯的实验操作名称为__________________,
②设计实验方案检验氯磺酸分解制取硫酰氯产品中混有硫酸,下列方案合理的是:_____(填字母)
A.取样品溶于水,滴加紫色石蕊溶液变红:再取少量溶液,加入BaCl2溶液产生白色沉淀,说明含有H2SO4。
B.取样品在干燥条件下加热至完全反应,冷却后直接加BaCl2溶液,有白色沉淀,再滴加紫色石蕊溶液变红,说明含有H2SO4。
(6)Li—SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解质溶液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2===4LiCl+S+SO2。
①写出该电池正极发生的电极反应式_______________________________
②组装该电池必须在无水、无氧的条件下进行,原因是__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C为三种链烃,其碳原子数有如下组合:
组 别 | 碳原子数 | ||
A | B | C | |
① | 3 | 3 | 6 |
② | 3 | 3 | 4 |
③ | 1 | 4 | 5 |
④ | 2 | 4 | 4 |
⑤ | 5 | 2 | 7 |
⑥ | 2 | 2 | 4 |
试回答下列问题:
(1)若B、C为烷烃,且在一定条件下C可分解(裂化)为A和B,则满足此条件的可能组别是(填组别序号)______________________________________________。
(2)若组别⑥中A为烷烃,B为炔烃,C为烯烃,且A、B、C三种物质按物质的量1:1:2混合,取标准状况下该混合物和过量O2组成的混合气体840mL,电火花点燃,将燃烧后的产物用过量碱石灰吸收,碱石灰增重0.93g。求:碱石灰吸收后所剩气体在标准状况下的体积 _______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com