
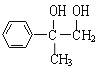
【题目】已知化合物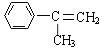 通过下图的反应过程可以制得化合物E和F,F可使溴的四氯化碳溶液褪色。
通过下图的反应过程可以制得化合物E和F,F可使溴的四氯化碳溶液褪色。
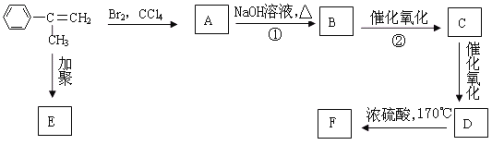
请回答下列问题:
(1)化合物E的结构简式为 :________________。
(2)写出化合物C中含氧官能团的名称:_________________、__________________;F的同分异构体有多种,其中苯环中只含有一个侧链且属于酯类化合物的有: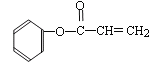 、_________________ 、_________________。(只要求写出其中两种的结构简式)。
、_________________ 、_________________。(只要求写出其中两种的结构简式)。
(3)写出过程①、②的化学反应方程式,并说明反应类型。
①___________________________,反应类型___________________;
②________________________,反应类型_____________________。
【答案】 羟基 醛基
羟基 醛基 ![]()
 (或
(或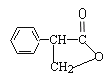 )
)  +2NaOH
+2NaOH![]()
 +2NaBr 水解反应或取代反应 2
+2NaBr 水解反应或取代反应 2 + O2
+ O2![]() 2
2 + 2H2O 氧化反应
+ 2H2O 氧化反应
【解析】
 与溴的四氯化碳溶液发生加成反应生成A为
与溴的四氯化碳溶液发生加成反应生成A为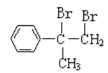 ,A在氢氧化钠溶液,加热的条件下发生卤代烃的水解反应生成B为
,A在氢氧化钠溶液,加热的条件下发生卤代烃的水解反应生成B为 ,B发生催化氧化生成C为
,B发生催化氧化生成C为 ,C继续发生催化氧化生成D为
,C继续发生催化氧化生成D为 ,F可使溴的四氯化碳溶液褪色,则D在浓硫酸,170。C的条件下发生消去反应生成F为
,F可使溴的四氯化碳溶液褪色,则D在浓硫酸,170。C的条件下发生消去反应生成F为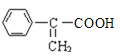 ,
, 发生加聚反应生成E为
发生加聚反应生成E为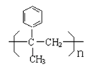 ,据此解答。
,据此解答。
(1)根据以上分析知,化合物E的结构简式为 ;
;
(2)化合物C为 ,含有的含氧官能团的名称为羟基、醛基;F为
,含有的含氧官能团的名称为羟基、醛基;F为 ,其同分异构体有多种,其中苯环中只含有一个侧链且属于酯类化合物,则该侧链中应含有一个酯基、一个碳碳双键,除了
,其同分异构体有多种,其中苯环中只含有一个侧链且属于酯类化合物,则该侧链中应含有一个酯基、一个碳碳双键,除了 ,还有
,还有![]() 、
、 、
、 ;
;
(3)反应①的化学反应方程式为 +2NaOH
+2NaOH![]()
 +2NaBr;反应类型为水解反应或取代反应;反应②的化学反应方程式为2
+2NaBr;反应类型为水解反应或取代反应;反应②的化学反应方程式为2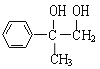 + O2
+ O2![]() 2
2 + 2H2O;反应类型为氧化反应。
+ 2H2O;反应类型为氧化反应。


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.由三种元素组成的化合物 A,按如下流程进行实验:
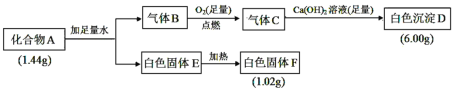
已知:①标准状况下,气体B的密度是氢气的8倍。②固体E既能溶于NaOH溶液又能溶于盐酸。
请回答:
(1)组成 A 的三种元素是__________,A 的化学式是________。
(2)固体 A 与足量稀盐酸反应的化学方程式是__________。
(3)气体 B 与足量 CuO 在加热条件下反应,请写出一个可能的化学方程式________________。
Ⅱ.某兴趣小组为探究 SO2 与 Fe(NO3)3 稀溶液反应的情况,实验装置如图,请回答:
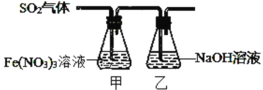
(1)实验过程中,甲中溶液由黄色变为浅绿色但立即又变为黄色。请写出甲中溶液由浅绿色变为黄色的离子方程式_____。
(2)请设计实验方案,检验反应后甲溶液中的金属阳离子______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CCl3CHO可通过“CH3CH2OH+4Cl2→CCl3CHO+5HCl”进行制备。
⑴实验室常用KMnO4、MnO2或NaClO与浓盐酸反应制取Cl2。质量分数为36.5%,密度为1.18 g·cm-3盐酸,其物质的量浓度为______mol·L1。等物质的量的KMnO4、MnO2或NaClO与足量浓盐酸反应,理论上生成的Cl2的质量之比为______。
⑵可用如下方法测定所制CCl3CHO粗品的纯度(杂质不参与反应):称取该实验制备的产品5.00 g,配成100.00 mL溶液,取其中10.00 mL,加入一定量的NaOH后,加入30.00 mL 0.100 mol·L1的碘标准液,用0.100 mol·L1的Na2S2O3溶液滴定,重复上述3次操作,消耗Na2S2O3溶液平均体积为20.00 mL。实验中所发生反应如下:CCl3CHO+NaOH=CHCl3+HCOONa,HCOONa+I2=HI+NaI+CO2↑, I2+2Na2S2O3=2NaI+Na2S4O6,计算粗品中所含CCl3CHO的质量分数(写出计算过程)。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的结构简式为![]() ,下列对它的描述正确的是( )
,下列对它的描述正确的是( )
A. 它能使溴水褪色,但不能使酸性高锰酸钾溶液褪色
B. 所有原子可能共平面
C. 易溶于水,也易溶于有机溶剂
D. 能发生加成反应,一定条件下最多可与三倍物质的量的氢气加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.乙酸和乙醇在浓硫酸作用下可以发生加成反应
B.分子式为C4H9Cl的同分异构体有4种
C.甲醇、乙二醇、丙三醇互为同系物
D.聚乙烯塑料可用于食品的包装,该塑料的老化是由于发生了加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向KI溶液中滴入少量新制氯水和四氯化碳,振荡、静置,溶液下层呈紫红色 | I的还原性强于Cl |
B | 向无水乙醇中加入浓H2SO4,加热,将产生的气体通入酸性KMnO4溶液,紫红色褪去 | 该气体一定是乙烯 |
C | 测定Na2CO3和Na2SiO3溶液的pH,后者pH比前者的大 | C的非金属性比Si强 |
D | 向1-溴丙烷中加入KOH溶液,加热几分钟,冷却后再加入AgNO3溶液,无淡黄色沉淀生成 | 1-溴丙烷没有水解 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为实验室制取乙烯并验证其性质的装置图。下列说法不正确的是( )
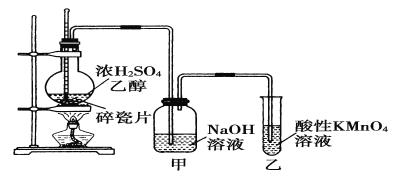
A.反应装置中浓硫酸和乙醇的体积比约为1:3
B.甲中NaOH溶液的作用是为了除去乙烯中的杂质气体
C.乙中溶液褪色,证明乙烯具有还原性
D.实验时,温度应该迅速升高到170℃并稳定在该温度最好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲醇(CH3OH)制备一些高附加值产品,是目前研究的热点。
(1)甲醇和水蒸气经催化重整可制得氢气,反应主要过程如下:
反应Ⅰ. CH3OH(g)+H2O(g)![]() 3H2(g)+CO2(g) △H1
3H2(g)+CO2(g) △H1
反应Ⅱ. H2(g)+CO2(g)![]() H2O(g)+CO(g) △H2= a kJ·mol-1
H2O(g)+CO(g) △H2= a kJ·mol-1
反应Ⅲ. CH3OH(g)![]() 2H2(g)+CO(g) △H3= b kJ·mol-1
2H2(g)+CO(g) △H3= b kJ·mol-1
反应Ⅳ. 2CH3OH(g)![]() 2H2O(g)+C2H4(g) △H4= c kJ·mol-1
2H2O(g)+C2H4(g) △H4= c kJ·mol-1
①△H1=______kJ·mol-1 。
②工业上采用CaO吸附增强制氢的方法,可以有效提高反应Ⅰ氢气的产率,如图1,请分析加入CaO提高氢气产率的原因:______。
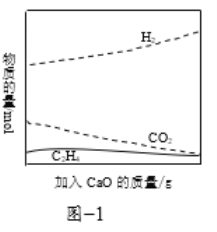
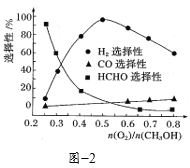
③在一定条件下用氧气催化氧化甲醇制氢气,原料气中![]() 对反应的选择性影响如题图2所示(选择性越大表示生成的该物质越多)。制备H2时最好控制
对反应的选择性影响如题图2所示(选择性越大表示生成的该物质越多)。制备H2时最好控制![]() =______,当
=______,当![]() = 0.25时,CH3OH和O2发生的主要反应方程式为______。
= 0.25时,CH3OH和O2发生的主要反应方程式为______。
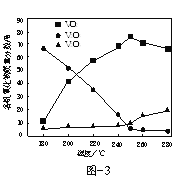
(2)以V2O5为原料,采用微波辅热-甲醇还原法可制备VO2,在微波功率1000kW下,取相同质量的反应物放入反应釜中,改变反应温度,保持反应时间为90min,反应温度对各钒氧化物质量分数的影响曲线如图3所示,温度高于250℃时,VO2的质量分数下降的原因是______。
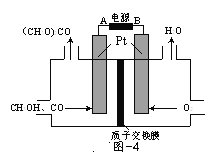
(3)以甲醇为原料,可以通过电化学方法合成碳酸二甲酯[(CH3O)2CO],工作原理如图4所示。
①电源的负极为______(填“A”或“B”)。
②阳极的电极反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向10mL 0.1mol/L NaOH溶液中加入0.1mol/L一元酸HA溶液后PH的变化如图所示。下列说法正确的是( )
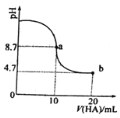
A.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.b点所示溶液中c(A-)>c(HA)
D.pH=7时,c(Na+)=c(A-)+c(HA)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com