
【题目】利用甲醇(CH3OH)制备一些高附加值产品,是目前研究的热点。
(1)甲醇和水蒸气经催化重整可制得氢气,反应主要过程如下:
反应Ⅰ. CH3OH(g)+H2O(g)![]() 3H2(g)+CO2(g) △H1
3H2(g)+CO2(g) △H1
反应Ⅱ. H2(g)+CO2(g)![]() H2O(g)+CO(g) △H2= a kJ·mol-1
H2O(g)+CO(g) △H2= a kJ·mol-1
反应Ⅲ. CH3OH(g)![]() 2H2(g)+CO(g) △H3= b kJ·mol-1
2H2(g)+CO(g) △H3= b kJ·mol-1
反应Ⅳ. 2CH3OH(g)![]() 2H2O(g)+C2H4(g) △H4= c kJ·mol-1
2H2O(g)+C2H4(g) △H4= c kJ·mol-1
①△H1=______kJ·mol-1 。
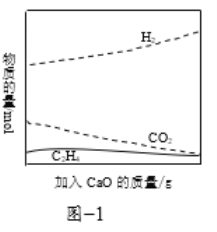
②工业上采用CaO吸附增强制氢的方法,可以有效提高反应Ⅰ氢气的产率,如图1,请分析加入CaO提高氢气产率的原因:______。
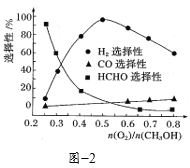
③在一定条件下用氧气催化氧化甲醇制氢气,原料气中![]() 对反应的选择性影响如题图2所示(选择性越大表示生成的该物质越多)。制备H2时最好控制
对反应的选择性影响如题图2所示(选择性越大表示生成的该物质越多)。制备H2时最好控制![]() =______,当
=______,当![]() = 0.25时,CH3OH和O2发生的主要反应方程式为______。
= 0.25时,CH3OH和O2发生的主要反应方程式为______。
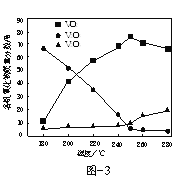
(2)以V2O5为原料,采用微波辅热-甲醇还原法可制备VO2,在微波功率1000kW下,取相同质量的反应物放入反应釜中,改变反应温度,保持反应时间为90min,反应温度对各钒氧化物质量分数的影响曲线如图3所示,温度高于250℃时,VO2的质量分数下降的原因是______。
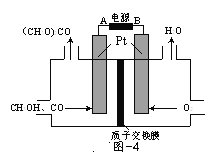
(3)以甲醇为原料,可以通过电化学方法合成碳酸二甲酯[(CH3O)2CO],工作原理如图4所示。
①电源的负极为______(填“A”或“B”)。
②阳极的电极反应式为______。
【答案】b –a CaO消耗CO2,降低CO2的浓度,促进平衡正向移动,提高H2的产率 0.5 2CH3OH+O2![]() 2HCHO+2H2O 甲醇继续还原VO2为V2O3 B 2CH3OH+CO 2e=(CH3O)2CO+2H+
2HCHO+2H2O 甲醇继续还原VO2为V2O3 B 2CH3OH+CO 2e=(CH3O)2CO+2H+
【解析】
(1)①这是一道典型的盖斯定律的应用,按要求来解题即可;
②氧化钙是碱性氧化物,二氧化碳是酸性氧化物,因此二者可以反应得到碳酸钙,二氧化碳被消耗后相当于生成物浓度降低,平衡将正向移动;
③根据题图不难看出最佳的投料比为0.5,当投料比为0.25时,甲醛的选择性非常高,因此此时主要是生成甲醛的反应;
(2)当温度升高时我们可以发现![]() 的质量分数在上升,温度升高后甲醇的还原性增强,将
的质量分数在上升,温度升高后甲醇的还原性增强,将![]() 进一步还原为
进一步还原为![]() ;
;
(3)根据装置图不难看出右侧在得电子,左侧在失电子,因此右侧为阴极,左侧为阳极,据此来解答即可。
(1)①不难看出,只要用反应III减去反应II,就可以得到![]() ,因此热效应也为反应III减去反应II,即
,因此热效应也为反应III减去反应II,即![]() ;
;
②氧化钙是碱性氧化物,二氧化碳是酸性氧化物,因此二者可以反应得到碳酸钙,二氧化碳被消耗后相当于生成物浓度降低,平衡将正向移动;
③根据题图不难看出,当投料比为0.5时,氢气的选择性最大,即可以得到更多的氢气,当投料比为0.25时,甲醛的选择性更大,即可以得到更多的甲醛![]() ;
;
(2)温度升高后甲醇的还原性增强,将![]() 进一步还原为
进一步还原为![]() ,因此
,因此![]() 的质量分数下降;
的质量分数下降;
(3)①右侧氧气得电子变成水,因此右侧是阴极,与阴极相连的B为电源负极,同理,左侧A为正极,与A相连的为阳极;
②阳极是甲醇、一氧化碳失电子变为碳酸二甲酯,据此写出电极反应式:![]() 。
。


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】已知实验室用浓硫酸和乙醇在一定温度下制备乙烯,某学习小组设计实验利用以下装置证明浓硫酸在该反应中的还原产物有SO2,并制备1,2-二溴乙烷。
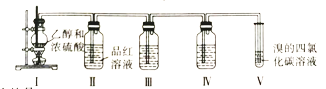
下列说法正确的是
A.浓硫酸在该反应中主要作用是催化剂、脱水剂
B.装置III、IV中的试剂依次为酸性高锰酸钾溶液、品红溶液
C.实验完毕后,采用萃取分液操作分离1,2-二溴乙烷
D.装置II中品红溶液褪色体现了SO2的还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氨气燃料电池,如图所示,下列说法不正确的是
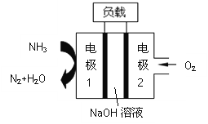
A.正极的电极反应式为O2+4e-+4H+=2H2O
B.电子流向:电极1→负载→电极2
C.Na+由左向右移动
D.NH3在电极1上发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如下能量关系示意图,下列说法正确的是
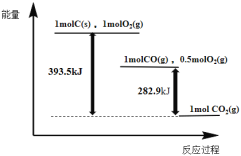
A.1 mol C(s)与1 mol O2(g)的能量之和为393.5 kJ
B.由C→CO的热化学方程式为:2C(s)+O2(g) = 2CO(g) ΔH= 221.2 kJmol1
C.反应2CO(g)+O2(g) =2CO2(g)中,生成物的总能量大于反应物的总能量
D.将1 mol C(s)磨成粉末后,反应更加剧烈,说明粉碎可以改变ΔH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同条件下,用O2氧化a mol/L FeCl2溶液过程中所测的实验数据如图所示。
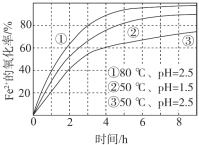
4Fe2+(aq)+4H+(aq)+O2(g)=4Fe3+(aq)+2H2O(l) ΔH>0
下列分析或推测合理的是
A.由①、②可知,pH越大,Fe2+越易被氧化
B.由②、③推测,若pH>7,Fe2+更难被氧化
C.pH=2.5、70℃时,0~3 h内Fe2+的平均消耗速率ν(Fe2+) < ![]() mol/(L·h)
mol/(L·h)
D.曲线②的变化趋势推测,反应吸热使得溶液温度下降,反应速率下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出石英主要成分的化学式:_____________;写出异丁烷的结构简式:_____________
(2)联氨(又称为肼,分子式为N2H4)一种高能燃料,常备用于火箭、航天领域,通常用过量NH3与NaClO反应制得。
①请写出NH3的电子式:________________________
②肼溶于水显弱碱性,其原理与氨相似。请用电离方程式解释肼的水溶液显碱性的原因是:________
③请写出上述制备肼的化学方程式:______________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学对化学反应提出了“原子经济性”(原子节约)的新概念及要求。理想的原子经济性反应是原料分子中的原子全部转变成所需产物,不产生副产物,实现零排放。下列几种生产乙苯的方法中,原子经济性最好的是(反应均在一定条件下进行)( )
A.![]() +C2H5Cl→
+C2H5Cl→![]() +HCl
+HCl
B.![]() +C2H5OH→
+C2H5OH→![]() +H2O
+H2O
C.![]() +CH2=CH2→
+CH2=CH2→![]()
D.![]() →
→![]() +HBr;
+HBr;![]() +H2→
+H2→![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池是化学电源的雏形。关于如图所示原电池的说法正确的是
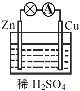
(1)如图连接好装置后,负极材料是__(填“Zn”或“Cu”),铜电极发生的现象:_____。
(2)相应原电池的总反应方程式为____。
(3)下列化学反应可通过原电池装置,可实现化学能直接转化为电能的是__(填序号)
①2NaOH+H2SO4=Na2SO4+2H2O
②Cu+2Fe3+=Cu2++2Fe2+
③C2H5OH+3O2![]() 2CO2+3H2O
2CO2+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
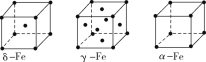
【题目】(1)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。回答下列问题:
①NiO、FeO的晶体结构类型均与NaCl的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点:FeO____(填“<”或“>”)NiO。
②铁有δ、γ、α三种同素异形体,各晶胞结构如图所示,则δ、α两种晶胞中铁原子的配位数之比为____。
(2)元素金(Au)处于周期表中的第六周期,与Cu同族,一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数目之比为__;该晶体中,原子之间的相互作用是____。
(3)某钙钛型复合氧化物如图所示,以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe等时,这种化合物具有CMR效应。
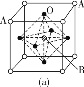
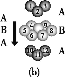
①用A、B、O表示这类特殊晶体的化学式:____。
②已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3(x<0.1),此时一部分锰转变为+4价,导致材料在某一温度附近有反铁磁—铁磁、铁磁—顺磁及金属—半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为____。
③下列有关说法正确的是____。
A.镧、锰、氧分别位于周期表f、d、p区
B.氧元素的第一电离能比氮元素的第一电离能大
C.锰的电负性为1.59,铬的电负性为1.66,说明锰的金属性比铬强
D.铬的堆积方式与钾相同,则其堆积方式如图(b)所示
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com