
【题目】原电池是化学电源的雏形。关于如图所示原电池的说法正确的是
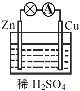
(1)如图连接好装置后,负极材料是__(填“Zn”或“Cu”),铜电极发生的现象:_____。
(2)相应原电池的总反应方程式为____。
(3)下列化学反应可通过原电池装置,可实现化学能直接转化为电能的是__(填序号)
①2NaOH+H2SO4=Na2SO4+2H2O
②Cu+2Fe3+=Cu2++2Fe2+
③C2H5OH+3O2![]() 2CO2+3H2O
2CO2+3H2O
【答案】Zn 气泡产生 Zn+H2SO4=ZnSO4+H2↑ ②③
【解析】
(1)根据原电池的构成条件及工作原理回答;
(1)根据原电池的工作原理可知,活泼金属做负极,所以该原电池中Zn做负极,Cu做正极;根据化学反应原理可知Zn+H2SO4=ZnSO4+H2↑,所以Cu电极有气泡产生;答案:Zn;气泡产生。
(2)根据化学反应原理可知相应原电池的总反应方程式为:Zn+H2SO4=ZnSO4+H2↑;答案:Zn+H2SO4=ZnSO4+H2↑。
(3)根据原电池的构成条件可知:自发进行的氧化还原反应,2NaOH+H2SO4=Na2SO4+2H2O不属于氧化还原反应,故①不能;②Cu+2Fe3+=Cu2++2Fe2+属于自发进行的氧化还原反应,所以②可实现化学能直接转化为电能;③C2H5OH+3O2![]() 2CO2+3H2O属于自发进行的氧化还原反应,所以③可实现化学能直接转化为电能;答案:②③。
2CO2+3H2O属于自发进行的氧化还原反应,所以③可实现化学能直接转化为电能;答案:②③。


科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是
A. 16.25gFeCl3水解形成的Fe(OH)3胶体粒子数为0.1NA
B. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
C. pH=1的H3PO4溶液中,含有0.1NA个H+
D. 10 g的D2O中含有的质子数与中子数分别为5NA和4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲醇(CH3OH)制备一些高附加值产品,是目前研究的热点。
(1)甲醇和水蒸气经催化重整可制得氢气,反应主要过程如下:
反应Ⅰ. CH3OH(g)+H2O(g)![]() 3H2(g)+CO2(g) △H1
3H2(g)+CO2(g) △H1
反应Ⅱ. H2(g)+CO2(g)![]() H2O(g)+CO(g) △H2= a kJ·mol-1
H2O(g)+CO(g) △H2= a kJ·mol-1
反应Ⅲ. CH3OH(g)![]() 2H2(g)+CO(g) △H3= b kJ·mol-1
2H2(g)+CO(g) △H3= b kJ·mol-1
反应Ⅳ. 2CH3OH(g)![]() 2H2O(g)+C2H4(g) △H4= c kJ·mol-1
2H2O(g)+C2H4(g) △H4= c kJ·mol-1
①△H1=______kJ·mol-1 。
②工业上采用CaO吸附增强制氢的方法,可以有效提高反应Ⅰ氢气的产率,如图1,请分析加入CaO提高氢气产率的原因:______。
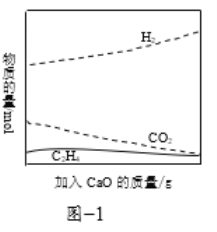
③在一定条件下用氧气催化氧化甲醇制氢气,原料气中![]() 对反应的选择性影响如题图2所示(选择性越大表示生成的该物质越多)。制备H2时最好控制
对反应的选择性影响如题图2所示(选择性越大表示生成的该物质越多)。制备H2时最好控制![]() =______,当
=______,当![]() = 0.25时,CH3OH和O2发生的主要反应方程式为______。
= 0.25时,CH3OH和O2发生的主要反应方程式为______。
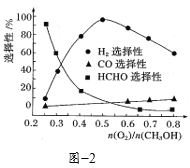
(2)以V2O5为原料,采用微波辅热-甲醇还原法可制备VO2,在微波功率1000kW下,取相同质量的反应物放入反应釜中,改变反应温度,保持反应时间为90min,反应温度对各钒氧化物质量分数的影响曲线如图3所示,温度高于250℃时,VO2的质量分数下降的原因是______。
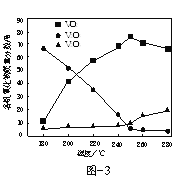
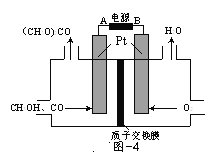
(3)以甲醇为原料,可以通过电化学方法合成碳酸二甲酯[(CH3O)2CO],工作原理如图4所示。
①电源的负极为______(填“A”或“B”)。
②阳极的电极反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe3O4中含有Fe(Ⅱ)、Fe(Ⅲ),以Fe3O4/Pd为催化材料,可实现用H2消除酸性废水中的致癌物NO2-,其反应过程如图所示。下列说法正确的是( )
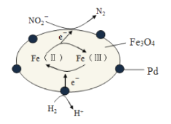
A.Pd作正极
B.Fe(Ⅱ)与Fe(Ⅲ)的相互转化起到了传递电子的作用
C.反应过程中NO2-被Fe(Ⅱ)氧化为N2
D.用该法处理后水体的pH降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有如下两个反应:(A)Cu2++Zn=Cu+Zn2+(B)2FeCl3+Cu=2FeCl2+CuCl2。
(1)分别画出两个实验装置图,注明电解质溶液名称和正负极材料,标出电子流动方向___、___。
(2)写出下列电极反应式:
①(A)中___是负极,负极反应式:___;
②(B)中___是负极,负极反应式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,改变某醋酸溶液的pH,溶液中c(CH3COO-)与c(CH3COOH)之和始终为0.1mol·L-1,溶液中H+、OH-、CH3COO-及CH3COOH浓度的常用对数值(lgc)与pH的关系如图所示。下列说法错误的是( )

A.图中③表示lgc(H+)与pH的关系曲线
B.0.1mol·L-1CH3COOH溶液的pH约为2.88
C.lgK(CH3COOH)=4.74
D.向0.10mol·L-1醋酸钠溶液中加入0.1mol醋酸钠固体,水的电离程度变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸镁晶须是一种新型的吸波隐形材料中的增强材料。
(1)合成该物质的步骤如下:
步骤1:配制0.5mol·L-1 MgSO4溶液和0.5mol·L-1 NH4HCO3溶液。
步骤2:用量筒量取500mL NH4HCO3溶液于1000mL三颈烧瓶中,开启搅拌器。温度控制在50℃。
步骤3:将250mL MgSO4溶液逐滴加入NH4HCO3溶液中,1min内滴加完后,用氨水调节溶液pH到9.5。
步骤4:放置1h后,过滤,洗涤。
步骤5:在40℃的真空干燥箱中干燥10h,得碳酸镁晶须产品(MgCO3·nH2O n=1~5)。
①步骤2控制温度在50℃,较好的加热方法是_________。
②步骤3生成MgCO3·nH2O沉淀的化学方程式为__________。
③步骤4检验沉淀是否洗涤干净的方法是__________。
(2)测定生成的MgCO3·nH2O中的n值。
称量1.000碳酸镁晶须,放入如图所示的广口瓶中加入适量水,并滴入稀硫酸与晶须反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5h,反应后期将温度升到30℃,最后将烧杯中的溶液用已知浓度的盐酸滴定,测得CO2的总量;重复上述操作2次。
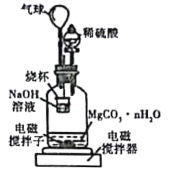
①图中气球的作用是_________。
②上述反应后期要升温到30℃,主要目的是______。
③测得每7.8000g碳酸镁晶须产生标准状况下CO2为1.12L,则n值为_______。
(3)碳酸镁晶须可由菱镁矿获得,为测定某菱镁矿(主要成分是碳酸镁,含少量碳酸亚铁、二氧化硅)中铁的含量,在实验室分别称取12.5g菱镁矿样品溶于过量的稀硫酸并完全转移到锥形瓶中,加入指示剂,用0.010mol/L H2O2溶液进行滴定。平行测定四组。消耗H2O2溶液的体积数据如表所示。
实验编号 | 1 | 2 | 3 | 4 |
消耗H2O2溶液体积/mL | 15.00 | 15.02 | 15.62 | 14.98 |
①H2O2溶液应装在_________(填“酸式”或“碱式”)滴定管中。
②根据表中数据,可计算出菱镁矿中铁元素的质量分数为_________ %(保留小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列有关说法正确的是
A.60克的乙酸和葡萄糖混合物充分燃烧消耗O2分子数为2NA
B.5.8g熟石膏(2CaSO4·H2O)含有的结晶水分子数为0.04NA
C.把4.6g乙醇完全氧化变成乙醛,转移电子数为0.1NA
D.实验室制取氧气方法有多种,制取1molO2转移电子数均是4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,用0.0200mol/L稀盐酸滴定20.00mL0.0200mol/LNaY溶液,溶液中水的电离程度随所加稀盐酸的体积变化如图所示(忽略滴定过程中溶液的体积变化或密度变化),则下列有关说法正确的是()
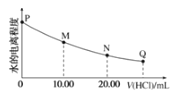
已知:K(HY)=5.0×10-11
A.M点溶液的pH>7
B.M点,c(Na+)=c(HY)+c(Y-)+c(Cl-)
C.可选取酚酞作为滴定指示剂
D.图中Q点水的电离程度最小,Kw<10-14
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com