
【题目】碳酸镁晶须是一种新型的吸波隐形材料中的增强材料。
(1)合成该物质的步骤如下:
步骤1:配制0.5mol·L-1 MgSO4溶液和0.5mol·L-1 NH4HCO3溶液。
步骤2:用量筒量取500mL NH4HCO3溶液于1000mL三颈烧瓶中,开启搅拌器。温度控制在50℃。
步骤3:将250mL MgSO4溶液逐滴加入NH4HCO3溶液中,1min内滴加完后,用氨水调节溶液pH到9.5。
步骤4:放置1h后,过滤,洗涤。
步骤5:在40℃的真空干燥箱中干燥10h,得碳酸镁晶须产品(MgCO3·nH2O n=1~5)。
①步骤2控制温度在50℃,较好的加热方法是_________。
②步骤3生成MgCO3·nH2O沉淀的化学方程式为__________。
③步骤4检验沉淀是否洗涤干净的方法是__________。
(2)测定生成的MgCO3·nH2O中的n值。
称量1.000碳酸镁晶须,放入如图所示的广口瓶中加入适量水,并滴入稀硫酸与晶须反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5h,反应后期将温度升到30℃,最后将烧杯中的溶液用已知浓度的盐酸滴定,测得CO2的总量;重复上述操作2次。
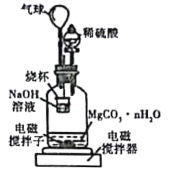
①图中气球的作用是_________。
②上述反应后期要升温到30℃,主要目的是______。
③测得每7.8000g碳酸镁晶须产生标准状况下CO2为1.12L,则n值为_______。
(3)碳酸镁晶须可由菱镁矿获得,为测定某菱镁矿(主要成分是碳酸镁,含少量碳酸亚铁、二氧化硅)中铁的含量,在实验室分别称取12.5g菱镁矿样品溶于过量的稀硫酸并完全转移到锥形瓶中,加入指示剂,用0.010mol/L H2O2溶液进行滴定。平行测定四组。消耗H2O2溶液的体积数据如表所示。
实验编号 | 1 | 2 | 3 | 4 |
消耗H2O2溶液体积/mL | 15.00 | 15.02 | 15.62 | 14.98 |
①H2O2溶液应装在_________(填“酸式”或“碱式”)滴定管中。
②根据表中数据,可计算出菱镁矿中铁元素的质量分数为_________ %(保留小数点后两位)。
【答案】水浴加热 MgSO4+NH4HCO3+NH3H2O+(n-1)H2O![]() MgCO3·nH2O↓+(NH4)2SO4 取最后一次洗涤液少许于试管中,加入稀盐酸,无明显现象,然后加入BaCl2溶液,若无白色沉淀,则沉淀已经洗涤干净 缓冲压强(或平衡压强),还可以起到封闭体系的作用 使广口瓶中溶解的CO2充分逸出,并被NaOH溶液充分吸收 4 酸式 0.13
MgCO3·nH2O↓+(NH4)2SO4 取最后一次洗涤液少许于试管中,加入稀盐酸,无明显现象,然后加入BaCl2溶液,若无白色沉淀,则沉淀已经洗涤干净 缓冲压强(或平衡压强),还可以起到封闭体系的作用 使广口瓶中溶解的CO2充分逸出,并被NaOH溶液充分吸收 4 酸式 0.13
【解析】
本实验题分为合成碳酸镁晶须、测定MgCO3·nH2O中n值、测定菱镁矿中铁的含量三部分。合成碳酸镁晶须是利用MgSO4溶液和NH4HCO3溶液、氨水反应生成。测定MgCO3·nH2O中n值,采用的是加稀硫酸,和MgCO3·nH2O反应,测定产生的CO2的体积,可以通过计算确定MgCO3·nH2O中n值。测定菱镁矿中铁的含量的原理是将菱镁矿中的铁转化为Fe2+,用H2O2溶液滴定,根据消耗的H2O2的物质的量以及电子守恒即可计算出菱镁矿中铁的含量。
(1)①步骤2控制温度在50℃,当温度不超过100℃时,较好的加热方法是水浴加热。水浴加热既可均匀加热,又可以很好地控制温度。
②MgSO4溶液和NH4HCO3溶液、氨水反应生成MgCO3·nH2O沉淀的同时还得到(NH4)2SO4,化学方程式为:MgSO4+NH4HCO3+NH3H2O+(n-1)H2O![]() MgCO3·nH2O↓+(NH4)2SO4。
MgCO3·nH2O↓+(NH4)2SO4。
③步骤4检验沉淀是否洗涤干净,可以检验洗涤液中的SO42-,方法是取最后一次洗涤液少许于试管中,加入稀盐酸,无明显现象,然后加入BaCl2溶液,若无白色沉淀,则沉淀已经洗涤干净。
(2)①图中气球可以缓冲压强(或平衡压强),还可以起到封闭体系的作用。
②上述反应后期要升温到30℃,主要目的是使广口瓶中溶解的CO2充分逸出,并被NaOH溶液充分吸收。
③标准状况下1.12LCO2的物质的量为0.05mol,根据碳守恒,有![]() =0.05mol,解得n=4。
=0.05mol,解得n=4。
(3)①H2O2溶液有强氧化性和弱酸性,应装在酸式滴定管中。
②四次实验数据,第3次和其他三次数据偏离较大,舍去,计算出三次实验消耗H2O2溶液体积的平均值为15.00mL。n(H2O2)=0.015L×0.010mol/L=1.5×10-4mol,在H2O2和Fe2+的反应中,H2O2做氧化剂,-1价氧的化合价降低到-2价,Fe2+中铁的化合价升高到+3价,根据电子守恒,n(Fe2+)=2(H2O2)= 3×10-4mol,则m(Fe)= 3×10-4mol×56g/mol=0.0168g,实验菱镁矿中铁元素的质量分数为![]() ×100%=0.13%。
×100%=0.13%。


科目:高中化学 来源: 题型:
【题目】某氨气燃料电池,如图所示,下列说法不正确的是
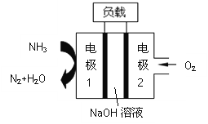
A.正极的电极反应式为O2+4e-+4H+=2H2O
B.电子流向:电极1→负载→电极2
C.Na+由左向右移动
D.NH3在电极1上发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学对化学反应提出了“原子经济性”(原子节约)的新概念及要求。理想的原子经济性反应是原料分子中的原子全部转变成所需产物,不产生副产物,实现零排放。下列几种生产乙苯的方法中,原子经济性最好的是(反应均在一定条件下进行)( )
A.![]() +C2H5Cl→
+C2H5Cl→![]() +HCl
+HCl
B.![]() +C2H5OH→
+C2H5OH→![]() +H2O
+H2O
C.![]() +CH2=CH2→
+CH2=CH2→![]()
D.![]() →
→![]() +HBr;
+HBr;![]() +H2→
+H2→![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池是化学电源的雏形。关于如图所示原电池的说法正确的是
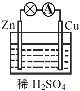
(1)如图连接好装置后,负极材料是__(填“Zn”或“Cu”),铜电极发生的现象:_____。
(2)相应原电池的总反应方程式为____。
(3)下列化学反应可通过原电池装置,可实现化学能直接转化为电能的是__(填序号)
①2NaOH+H2SO4=Na2SO4+2H2O
②Cu+2Fe3+=Cu2++2Fe2+
③C2H5OH+3O2![]() 2CO2+3H2O
2CO2+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑(Sb)广泛用于生产各种阻燃剂、陶瓷、半导体元件和医药及化工等领域。
Ⅰ.(1)锑在元素周期表中的位置_____。
(2)锑(Ⅲ)的氧化物被称为锑白,可以由SbCl3水解制得,已知SbCl3水解的最终产物为锑白。为了得到较多、较纯的锑白,操作时将SbCl3徐徐加入大量水中,反应后期还要加入少量氨水。试用必要的化学用语和平衡移动原理解释这两项操作的作用_______。工业上,还可用火法制取锑白,是将辉锑矿(主要成分为Sb2S3)装入氧化炉的坩埚中,高温使其融化后通入空气,充分反应后,经冷却生成锑白。写出火法制取锑白的化学方程式______。
Ⅱ.以辉锑矿为原料制备金属锑,其中一种工艺流程如下:
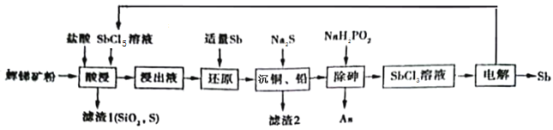
已知部分信息如下:
①辉锑矿(除Sb2S3外,还含有砷、铅、铜的化合物和SiO2等);
②浸出液主要含盐酸和SbCl3,还含SbCl5、CuCl2、AsCl3和PbCl2等杂质;
③常温下,Ksp(CuS)=1.0×10-36,Ksp(PbS)=9.0×10-29。
回答下列问题:
(3)“酸浸”过程中Sb2S3发生反应的化学方程式为_____。
(4)已知:浸出液中c(Cu2+)=0.0001mol/L,c( Pb2+)=0.1mol/L。在沉淀铜、铅过程中,缓慢滴加极稀的硫化钠溶液,先产生沉淀的是_____(填化学式);当CuS、PbS共沉沉时,![]() =______(保留小数点后一位)。
=______(保留小数点后一位)。
(5)在“除砷”过程中,氧化产物为H3PO4。该反应氧化产物与还原产物的物质的量之比为__________。
(6)在“电解”过程中,锑的产率与电压大小关系如图所示。当电压超过U0 V时,锑的产率降低的原因可能是_________。
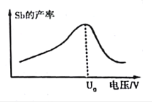
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】八十年代,我国化学家打破了西方国家对维生素C的垄断,发明的“两段发酵法”大大降低了生产成本。某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式如下:
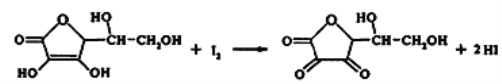
下列说法正确的是
A. 上述反应为取代反应
B. 维生素C水解得到2种产物
C. 维生素C有酯基不能溶于水,可溶于有机溶剂
D. 该反应表明维生素C具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
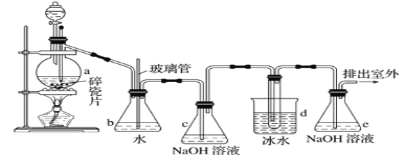
【题目】抗爆剂的添加剂常用1,2-二溴乙烷。如图为实验室制备1,2-二溴乙烷的装置图, 图中分液漏斗和烧瓶a中分别装有浓H2SO4和无水乙醇,d装罝试管中装有液溴。
相关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | 溴 | |
状态 | 无色液体 | 无色液体 | 无色液体 | 红棕色液体 |
密度/g·cm-3 | 0.79 | 2.18 | 0.71 | 3.10 |
沸点/℃ | 78.5 | 131.4 | 34.6 | 58.8 |
熔点/℃ | -114.3 | 9.79 | - 116.2 | -7.2 |
水溶性 | 混溶 | 难溶 | 微溶 | 可溶 |
(1)安全瓶b在实验中有多重作用。其一可以检查实验进行中d装罝中导管是否发生堵塞,请写出发生堵塞时瓶b中的现象:①_____________________________;如果实验时d装罝中导管堵塞,你认为可能的原因是②___________________________________;
安全瓶b还可以起到的作用是③___________________________。
(2)容器c、e中都盛有NaOH溶液,c中NaOH溶液的作用是_______________________。
(3)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正确情况下超过许多,如果装罝的气密性没有问题,试分析可能的原因:_____________________、_____________________________(写出两条即可)。
(4)除去产物中少量未反应的Br2后,还含有的主要杂质为________________,要进一步提纯,下列操作中必需的是
A.重结晶 B.过滤 C.萃取 D.蒸馏
(5)实验中也可以撤去d装置中盛冰水的烧杯,改为将冷水直接加入到d装置的试管中,则此时冷水除了能起到冷却1,2-二溴乙烷的作用外,还可以起到的作用是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。回答下列问题:
①NiO、FeO的晶体结构类型均与NaCl的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点:FeO____(填“<”或“>”)NiO。
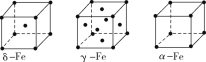
②铁有δ、γ、α三种同素异形体,各晶胞结构如图所示,则δ、α两种晶胞中铁原子的配位数之比为____。
(2)元素金(Au)处于周期表中的第六周期,与Cu同族,一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数目之比为__;该晶体中,原子之间的相互作用是____。
(3)某钙钛型复合氧化物如图所示,以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe等时,这种化合物具有CMR效应。
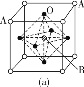
①用A、B、O表示这类特殊晶体的化学式:____。
②已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3(x<0.1),此时一部分锰转变为+4价,导致材料在某一温度附近有反铁磁—铁磁、铁磁—顺磁及金属—半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为____。
③下列有关说法正确的是____。
A.镧、锰、氧分别位于周期表f、d、p区
B.氧元素的第一电离能比氮元素的第一电离能大
C.锰的电负性为1.59,铬的电负性为1.66,说明锰的金属性比铬强
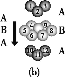
D.铬的堆积方式与钾相同,则其堆积方式如图(b)所示
查看答案和解析>>
科目:高中化学 来源: 题型:
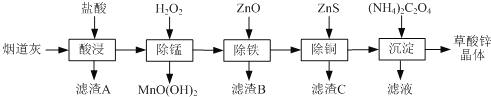
【题目】以炼锌厂的烟道灰(主要成分为ZnO,另含少量Fe2O3、CuO、SiO2、MnO等)为原料可生产草酸锌晶体(ZnC2O42H2O)
已知:常温下Ksp[Fe(OH)3]=2.6×10-39, Ksp[Cu(OH)2]=2.2×10-20。
请问答下列问题:
(1)为了提高“酸浸”时锌元素的浸出率,可以采取的措施有:_________、________(填写2条)。
(2)“除锰”反应后,溶液的pH__________(填“增大”“减小”或“不变”)。
(3)常温下“除铁”反应中,加入ZnCO3可调节溶液的pH,使得Fe3+和部分Cu2+被除去,当两种沉淀共存且溶液的pH=8时,c(Cu2+)/ c( Fe3+)=________________ 。
(4)“除铜”反应的离子方程式为________。
(5)若“沉淀”过程中采用Na2C2O4代替(NH4)2C2O4生产草酸锌晶体,应该在搅拌下,将Na2C2O4溶液缓慢加入ZnCl2溶液中,如果顺序颠倒,会产生的不良后果是__________。
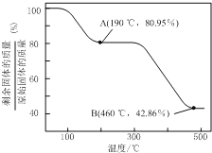
(6)将草酸锌晶体加热分解可得到一种纳米材料。加热过程中固体残留率(剩余固体的质量/原始固体的质量×100%)随温度的变化如图所示,则A、B点固体的化学式分别为____、___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com