
【题目】室温时,用0.0200mol/L稀盐酸滴定20.00mL0.0200mol/LNaY溶液,溶液中水的电离程度随所加稀盐酸的体积变化如图所示(忽略滴定过程中溶液的体积变化或密度变化),则下列有关说法正确的是()
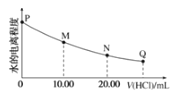
已知:K(HY)=5.0×10-11
A.M点溶液的pH>7
B.M点,c(Na+)=c(HY)+c(Y-)+c(Cl-)
C.可选取酚酞作为滴定指示剂
D.图中Q点水的电离程度最小,Kw<10-14
【答案】A
【解析】
根据题意,NaY是强碱弱酸盐,向其溶液中加盐酸,会发生强酸制弱酸的反应,生成HY;当加入的盐酸是NaY物质的量的一半时,即V(HCl)=10mL时,充分混合后,溶液可认为是等浓度的NaY和HY的混合溶液,当然溶质还有NaCl;当加入的盐酸与NaY物质的量相等时,即V(HCl)=20mL时,充分混合,溶液可认为是HY的溶液,当然溶质还有NaCl;若V(HCl)>20mL,那么溶液中的溶质组成为HY和NaCl以及HCl。
A.根据分析可知,M点的溶液可认为是等浓度的NaY和HY的混合溶液,又因为![]() ,那么室温下,
,那么室温下,![]() ,所以NaY的水解程度比HY的电离程度更大,溶液显碱性,A项正确;
,所以NaY的水解程度比HY的电离程度更大,溶液显碱性,A项正确;
B.无论加入的盐酸体积是多少,均有物料守恒关系式为:![]() ;M点加入的盐酸体积不为0,所以有:
;M点加入的盐酸体积不为0,所以有:![]() ,B项错误;
,B项错误;
C.当加入的盐酸与NaY物质的量相等时,达到滴定终点,此时溶液可认为是HY的溶液,当然溶质还有NaCl;所以终点时溶液显酸性,因此应当用甲基橙作指示剂,C项错误;
D.Q点时,V(HCl)>20mL,溶液中的溶质组成为HY和NaCl以及HCl,相比于图像中的其他点,水的电离程度最小,但是![]() 只与温度有关,所以室温下,仍为10-14,D项错误;
只与温度有关,所以室温下,仍为10-14,D项错误;
答案选A。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】原电池是化学电源的雏形。关于如图所示原电池的说法正确的是
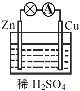
(1)如图连接好装置后,负极材料是__(填“Zn”或“Cu”),铜电极发生的现象:_____。
(2)相应原电池的总反应方程式为____。
(3)下列化学反应可通过原电池装置,可实现化学能直接转化为电能的是__(填序号)
①2NaOH+H2SO4=Na2SO4+2H2O
②Cu+2Fe3+=Cu2++2Fe2+
③C2H5OH+3O2![]() 2CO2+3H2O
2CO2+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。回答下列问题:
①NiO、FeO的晶体结构类型均与NaCl的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点:FeO____(填“<”或“>”)NiO。
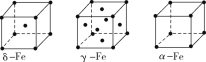
②铁有δ、γ、α三种同素异形体,各晶胞结构如图所示,则δ、α两种晶胞中铁原子的配位数之比为____。
(2)元素金(Au)处于周期表中的第六周期,与Cu同族,一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数目之比为__;该晶体中,原子之间的相互作用是____。
(3)某钙钛型复合氧化物如图所示,以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe等时,这种化合物具有CMR效应。
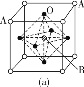
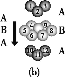
①用A、B、O表示这类特殊晶体的化学式:____。
②已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3(x<0.1),此时一部分锰转变为+4价,导致材料在某一温度附近有反铁磁—铁磁、铁磁—顺磁及金属—半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为____。
③下列有关说法正确的是____。
A.镧、锰、氧分别位于周期表f、d、p区
B.氧元素的第一电离能比氮元素的第一电离能大
C.锰的电负性为1.59,铬的电负性为1.66,说明锰的金属性比铬强
D.铬的堆积方式与钾相同,则其堆积方式如图(b)所示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.100g质量分数为17%的H2O2水溶液中含氧原子数目为NA
B.0.1molH2(g)与0.1molI2(g)于密闭容器中充分反应生成HI(g)后,其分子总数小于0.2NA
C.8.0gCH4与足量Cl2在光照下反应生成的HCl分子数最多为2NA
D.标准状况下,将54g铝片投入足量冷的浓硝酸中生成134.4LNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如下能量关系示意图,下列说法正确的是
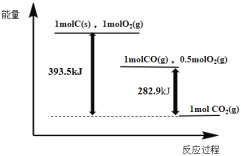
A.1 mol C(s)与1 mol O2(g)的能量之和为393.5 kJ
B.由C→CO的热化学方程式为:2C(s)+O2(g) = 2CO(g) ΔH= 221.2 kJmol1
C.反应2CO(g)+O2(g) =2CO2(g)中,生成物的总能量大于反应物的总能量
D.将1 mol C(s)磨成粉末后,反应更加剧烈,说明粉碎可以改变ΔH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列对于Na2SO3与NaHSO3的混合溶液中微粒浓度关系的说法正确的是()
A.一定存在3c(Na+)=c(HSO3)+c(SO32)+c(H2SO3)
B.一定存在c(Na+)+c(H+)=c(HSO3)+c(SO32)+c(OH-)
C.若混合溶液中n(Na2SO3)=2n(NaHSO3)时,溶液呈碱性,则有c(Na+)>c(SO32)>c(HSO3)>c(OH)>c(H+)
D.若混合溶液中n(Na2SO3)=n(NaHSO3)时,溶液呈酸性,则有c(Na+)>c(HSO3)>c(H+)>c(SO32)>c(OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以炼锌厂的烟道灰(主要成分为ZnO,另含少量Fe2O3、CuO、SiO2、MnO等)为原料可生产草酸锌晶体(ZnC2O42H2O)
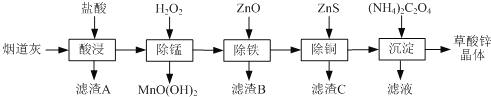
已知:常温下Ksp[Fe(OH)3]=2.6×10-39, Ksp[Cu(OH)2]=2.2×10-20。
请问答下列问题:
(1)为了提高“酸浸”时锌元素的浸出率,可以采取的措施有:_________、________(填写2条)。
(2)“除锰”反应后,溶液的pH__________(填“增大”“减小”或“不变”)。
(3)常温下“除铁”反应中,加入ZnCO3可调节溶液的pH,使得Fe3+和部分Cu2+被除去,当两种沉淀共存且溶液的pH=8时,c(Cu2+)/ c( Fe3+)=________________ 。
(4)“除铜”反应的离子方程式为________。
(5)若“沉淀”过程中采用Na2C2O4代替(NH4)2C2O4生产草酸锌晶体,应该在搅拌下,将Na2C2O4溶液缓慢加入ZnCl2溶液中,如果顺序颠倒,会产生的不良后果是__________。
(6)将草酸锌晶体加热分解可得到一种纳米材料。加热过程中固体残留率(剩余固体的质量/原始固体的质量×100%)随温度的变化如图所示,则A、B点固体的化学式分别为____、___________。
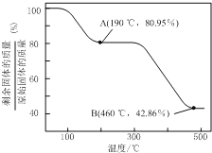
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)MnO2在反应中____电子(填“得到”或“失去”),所含元素化合价______(填“升高”或“降低”),发生_____反应(填“氧化”或“还原”)。
(2)HCl在反应中_____电子(填“得到”或“失去”),所含元素化合价_____(填“升高”或“降低”),发生____反应(填“氧化”或“还原”)。
(3)该反应中氧化剂是___;还原剂是____;氧化产物是___ ;还原产物是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化合物YX2和ZX2中,已知X、Y、Z都是前三周期的元素,X与Y同周期,Y与Z同主族,Y原子的最外层电子数是次外层电子数的2倍;X原子最外层上有6个电子。根据以上条件,回答问题:
(1)Y的原子结构示意图为___。
(2)YX2的结构式是___,分子内的共价键是___(填“极性键”或“非极性键”)。
(3)ZX2的化学式为___。
(4)用电子式表示YX2的形成过程___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com