
【题目】25℃时,下列对于Na2SO3与NaHSO3的混合溶液中微粒浓度关系的说法正确的是()
A.一定存在3c(Na+)=c(HSO3)+c(SO32)+c(H2SO3)
B.一定存在c(Na+)+c(H+)=c(HSO3)+c(SO32)+c(OH-)
C.若混合溶液中n(Na2SO3)=2n(NaHSO3)时,溶液呈碱性,则有c(Na+)>c(SO32)>c(HSO3)>c(OH)>c(H+)
D.若混合溶液中n(Na2SO3)=n(NaHSO3)时,溶液呈酸性,则有c(Na+)>c(HSO3)>c(H+)>c(SO32)>c(OH)
【答案】C
【解析】
A.由于溶液为Na2SO3和NaHSO3的混合溶液,所以溶液中的钠元素总量一定大于硫元素总量,所以一定不存在![]() ,A项错误;
,A项错误;
B.混合溶液无论Na2SO3和NaHSO3比例是什么,均有电荷守恒式:![]() 成立,所以选项中的等式一定不成立,B项错误;
成立,所以选项中的等式一定不成立,B项错误;
C.由于n(Na2SO3)=2n(NaHSO3),所以溶液中钠离子浓度最大,由于弱电解质的电离和盐类的水解平衡进行的程度都十分微弱,所以![]() 和
和![]() 的浓度依次排在第二和第三,由于溶液显碱性,所以
的浓度依次排在第二和第三,由于溶液显碱性,所以![]() 浓度大于
浓度大于![]() 浓度,C项正确;
浓度,C项正确;
D.由于n(Na2SO3)=n(NaHSO3),并且混合溶液呈酸性,所以![]() 的电离程度大于
的电离程度大于![]() 的水解程度,即相比于
的水解程度,即相比于![]() ,
,![]() 消耗的更多溶液中剩余的更少;又因为弱电解质的电离和盐类的水解平衡进行的程度都十分微弱,所以有:
消耗的更多溶液中剩余的更少;又因为弱电解质的电离和盐类的水解平衡进行的程度都十分微弱,所以有:![]() ,D项错误;
,D项错误;
答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】25℃时,改变某醋酸溶液的pH,溶液中c(CH3COO-)与c(CH3COOH)之和始终为0.1mol·L-1,溶液中H+、OH-、CH3COO-及CH3COOH浓度的常用对数值(lgc)与pH的关系如图所示。下列说法错误的是( )

A.图中③表示lgc(H+)与pH的关系曲线
B.0.1mol·L-1CH3COOH溶液的pH约为2.88
C.lgK(CH3COOH)=4.74
D.向0.10mol·L-1醋酸钠溶液中加入0.1mol醋酸钠固体,水的电离程度变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10 mL 0.1 mol/L CuCl2溶液中滴加0.1mol/L的Na2S溶液,滴加过程中-lg c(Cu2+)与Na2S溶液体积的关系如图所示.下列有关说法正确的是( )

A.0.1mol/LNa2S溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S)
B.a、b、c三点对应的溶液中,水的电离程度最大的为b点
C.该温度下,Ksp(CuS)的数量级为10-36
D.向10 mL Ag+、Cu2+物质的量浓度均为0.1mol/L的混合溶液中逐滴加入0.01mol/L的Na2S溶液,Cu2+先沉淀[已知:Ksp(Ag2S)=6.4×10-50]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应均可获取H2。下列有关说法正确的是()
①太阳光催化分解水制氢:2H2O(l)═2H2(g)+O2(g)△H1=+571.6kJ/mol
②焦炭与水反应制氢:C(s)+H2O(g)═CO(g)+H2(g)△H2=+131.3kJ/mol
③甲烷与水反应制氢:CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+206.1kJ/mol
A.反应①中电能转化为化学能
B.反应②为放热反应
C.反应CH4(g)═C(s)+2H2(g)的△H=74.8kJ/mol
D.反应③使用催化剂,△H3不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,用0.0200mol/L稀盐酸滴定20.00mL0.0200mol/LNaY溶液,溶液中水的电离程度随所加稀盐酸的体积变化如图所示(忽略滴定过程中溶液的体积变化或密度变化),则下列有关说法正确的是()
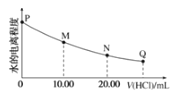
已知:K(HY)=5.0×10-11
A.M点溶液的pH>7
B.M点,c(Na+)=c(HY)+c(Y-)+c(Cl-)
C.可选取酚酞作为滴定指示剂
D.图中Q点水的电离程度最小,Kw<10-14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸钠(NaH2PO2)是有机合成的常用还原剂,一般制备方法是将黄磷(P4)和过量烧碱溶液混合、加热,生成次磷酸钠和PH3,PH3是一种无色、有毒且能自燃的气体。实验装置如图所示:
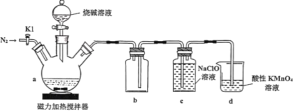
回答下列问题:
(1)在a中加入黄磷、活性炭粉末,打开K1,通入N2一段时间,关闭K1,打开磁力加热搅拌器,滴加烧碱溶液。
①仪器a的名称是______,已知NaH2PO2能与盐酸反应但不能与NaOH溶液反应,则次磷酸(H3PO2)是_______元弱酸。
②反应开始时,首先打开K1,通入N2一段时间,其目的是________。
③为了尽可能避免PH3造成的空气污染,拆卸装置前还要进行的一项操作是_________,a中反应的化学方程式为_______。
(2)装置c中生成NaH2PO2和NaCl,相关物质溶解度(S)如下,通过______的方法可分离出NaH2PO2固体。

(3)产品纯度测定:
取产品m g配成250mL溶液,取25mL于锥形瓶中,然后用0.01 mol/L KMnO4标准溶液滴定至终点(氧化产物是PO43-),达到滴定终点时消耗V1 mL KMnO4标准溶液,产品纯度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某配位化合物为深蓝色晶体,由原子序数由小到大的A,B,C,D,E五种元素组成,其原子个数比为14∶4∶5∶1∶1。其中C,D同主族且原子序数D为C的2倍,E元素的外围电子排布式为(n-1)dn+6ns1,试回答下列问题:
(1)元素B,C,D的第一电离能由大到小排列顺序为________(用元素符号表示)。
(2)D元素基态原子的最外层电子排布图为________。
(3)该配位化合物的化学式为________,配体的中心原子的杂化方式为________。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1∶1和1∶2,两种化合物可以任意比互溶,解释其主要原因为_______________。
(5)A元素与B元素可形成分子式为B2A2的某化合物,该化合物的分子具有平面结构,则其结构式为________,分子中含有________个σ键,________个π键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示是实验室制取SO2并验证SO2某些性质的装置图。试回答:
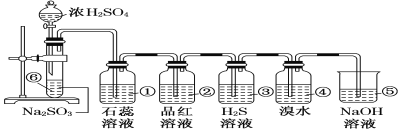
(1)⑥中发生反应的化学方程式为______。
(2)①中的实验现象为_______。
(3)②中的实验现象为______,证明SO2有_____性。
(4)③中的实验现象是______,证明SO2有______性。
(5)④中的实验现象是_____,证明SO2有______性。
(6)⑤的作用是______,反应的化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.甲烷分子的比例模型为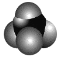 ,其二氯取代物有 2 种结构
,其二氯取代物有 2 种结构
B.苯和乙烯都能使溴水褪色,其褪色原理相同
C.相同质量的乙炔与苯分别在足量的氧气中完全燃烧,消耗氧气的物质的量相同
D.在一定条件下,乙烯与氢气反应生成乙烷属于取代反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com