
【题目】如下图所示是实验室制取SO2并验证SO2某些性质的装置图。试回答:
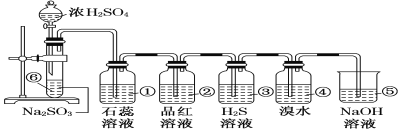
(1)⑥中发生反应的化学方程式为______。
(2)①中的实验现象为_______。
(3)②中的实验现象为______,证明SO2有_____性。
(4)③中的实验现象是______,证明SO2有______性。
(5)④中的实验现象是_____,证明SO2有______性。
(6)⑤的作用是______,反应的化学方程式为_______。
【答案】Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O 石蕊溶液变红 品红溶液褪色 漂白 有黄色沉淀产生 氧化 溴水褪色 还原 吸收多余的二氧化硫 SO2+2NaOH=Na2SO3+H2O
【解析】
根据实验装置分析可知,⑥中Na2SO3和浓H2SO4发生反应Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O制取SO2,①为检验SO2的酸性的装置,②为检验SO2的漂白性的装置,③为检验SO2的氧化性的装置,④为检验SO2的还原性的装置,⑤为尾气处理装置,据此分析解答。
(1)⑥中为亚硫酸钠和浓硫酸反应生成二氧化硫气体,反应的化学方程式为Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑;
(2)二氧化硫溶于水和水反应生成亚硫酸,亚硫酸为二元中强酸,可以使紫色石蕊试液变红,即①中的实验现象为石蕊试液变红;
(3)二氧化硫与品红化合生成无色物质,能使品红溶液褪色,故二氧化硫具有漂白性;
(4)SO2中+4价S具有氧化性,硫化氢中-2价S具有还原性,二氧化硫能把硫化氢氧化成单质硫,本身被还原成单质硫,反应方程式为SO2+2H2S=3S↓+2H2O,所以③中的实验现象是有淡黄色沉淀生成,证明了SO2具有氧化性;
(5)二氧化硫具有还原性,能被溴水氧化而使其褪色;
(6)二氧化硫有毒,不能直接排放到空气中,二氧化硫能够与氢氧化钠反应生成亚硫酸钠和水,所以可以用氢氧化钠溶液吸收二氧化硫,即⑤的作用是吸收多余的二氧化硫,防止二氧化硫污染环境,反应的化学方程式为SO2+2NaOH=Na2SO3+H2O。


科目:高中化学 来源: 题型:
【题目】元素X、Y、Z在周期表中的相对位置如图所示。已知Y元素原子的外围电子排布为ns(n-1)np(n+1),则下列说法不正确的是( )
![]()
A. Y元素原子的外围电子排布为4s24p4
B. Y元素在周期表的第三周期ⅥA族
C. X元素所在周期中所含非金属元素最多
D. Z元素原子的核外电子排布式为1s22s22p63s23p63d104s24p3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列对于Na2SO3与NaHSO3的混合溶液中微粒浓度关系的说法正确的是()
A.一定存在3c(Na+)=c(HSO3)+c(SO32)+c(H2SO3)
B.一定存在c(Na+)+c(H+)=c(HSO3)+c(SO32)+c(OH-)
C.若混合溶液中n(Na2SO3)=2n(NaHSO3)时,溶液呈碱性,则有c(Na+)>c(SO32)>c(HSO3)>c(OH)>c(H+)
D.若混合溶液中n(Na2SO3)=n(NaHSO3)时,溶液呈酸性,则有c(Na+)>c(HSO3)>c(H+)>c(SO32)>c(OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,在800 mL的大烧杯中放入碎纸屑把盛有50 mL 0.50 mol·L-1盐酸的100 mL烧杯放到大烧杯中,两只烧杯间填满碎纸屑。用泡沫塑料板做成大烧杯盖,通过盖子插入一根环形玻璃搅拌棒和一支温度计,测定溶液的温度。迅速往盐酸中加入 50 mL 0.55 mol·L-1NaOH溶液,盖好盖子,搅拌溶液,观察温度的变化。当温度保持稳定时,记录读数,取出装有反应液的烧杯,倒出溶液,清洗干净,保持内外杯壁干燥。重复进行三次实验。用这一实验可以粗略测定中和热。
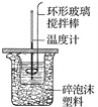
(1)烧杯间填满碎纸屑的作用是____________。
(2)要重复进行三次实验的目的是_____________。
(3)烧杯若不盖泡沫塑料板,求得的中和热数值将________(填“偏大”“偏小”或“无影响”)。
(4)实验中若改用60 mL 0.50 mol·L-1盐酸和50 mL 0.55 mol·L-1NaOH溶液进行上述反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热________(填“相等”或“不相等”),理由是_______。
(5)三次实验测得的数据中,起始时盐酸与NaOH溶液温度相同,而终止温度与起始温度之差(t2-t1)分别为①2.3 ℃,②2.4 ℃,③2.5 ℃。则最终代入计算式的温度差的平均值为________℃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)MnO2在反应中____电子(填“得到”或“失去”),所含元素化合价______(填“升高”或“降低”),发生_____反应(填“氧化”或“还原”)。
(2)HCl在反应中_____电子(填“得到”或“失去”),所含元素化合价_____(填“升高”或“降低”),发生____反应(填“氧化”或“还原”)。
(3)该反应中氧化剂是___;还原剂是____;氧化产物是___ ;还原产物是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是
A. 原子半径:r(W) > r(Z) > r(Y)
B. 由X、Y 组成的化合物中均不含共价键
C. Y 的最高价氧化物的水化物的碱性比Z的弱
D. X 的简单气态氢化物的热稳定性比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符合的是
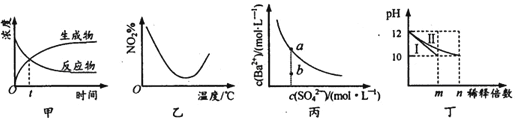
A. 图甲表示某可逆反应中物质浓度随时间的变化,反应在t时刻达到平衡状态
B. 图乙表示NO2在恒容密闭容器中发生反应:2NO2(g)![]() N2O4(g),NO2体积分数与温度的变化曲线,则该反应的正反应△H<O
N2O4(g),NO2体积分数与温度的变化曲线,则该反应的正反应△H<O
C. 图丙表示某温度时,BaSO4在水中的溶解平衡曲线,蒸发水可使溶液由b点变到a点
D. 图丁表示分别稀释l0mLpH均为12的NaOH和NH3·H2O溶液时pH的变化,曲线I表示NH3 H2O溶液,n>100
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是

A. 铁被氧化的电极反应式为Fe3e![]() Fe3+
Fe3+
B. 铁腐蚀过程中化学能全部转化为电能
C. 活性炭的存在会加速铁的腐蚀
D. 以水代替NaCl溶液,铁不能发生吸氧腐蚀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com