
����Ŀ��ij��λ������Ϊ����ɫ���壬��ԭ��������С�����A��B��C��D��E����Ԫ����ɣ���ԭ�Ӹ�����Ϊ14��4��5��1��1������C��Dͬ������ԭ������DΪC��2����EԪ�ص���Χ�����Ų�ʽΪ(n��1)dn��6ns1���Իش��������⣺
��1��Ԫ��B��C��D�ĵ�һ�������ɴ�С����˳��Ϊ________(��Ԫ�ط��ű�ʾ)��
��2��DԪ�ػ�̬ԭ�ӵ����������Ų�ͼΪ________��
��3������λ������Ļ�ѧʽΪ________�����������ԭ�ӵ��ӻ���ʽΪ________��
��4��CԪ�ؿ���AԪ���γ����ֳ����Ļ������ԭ�Ӹ����ȷֱ�Ϊ1��1��1��2�����ֻ������������Ȼ��ܣ���������Ҫԭ��Ϊ_______________��
��5��AԪ����BԪ�ؿ��γɷ���ʽΪB2A2��ij������û�����ķ��Ӿ���ƽ��ṹ������ṹʽΪ________�������к���________���Ҽ���________���м���
���𰸡�N��O��S 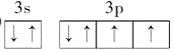 [Cu(NH3)4]SO4��H2O[��Cu(NH3)4SO4��H2O] sp3�ӻ� H2O2������H2O����֮���γ����(����������ԭ�������ӽṹ���Ƶ��������ܵȽǶȻش�ֻҪ�𰸺�������) H��N=N��H 3 1
[Cu(NH3)4]SO4��H2O[��Cu(NH3)4SO4��H2O] sp3�ӻ� H2O2������H2O����֮���γ����(����������ԭ�������ӽṹ���Ƶ��������ܵȽǶȻش�ֻҪ�𰸺�������) H��N=N��H 3 1
��������
ij��λ������Ϊ����ɫ���壬��ԭ��������С�����A��B��C��D��E����Ԫ����ɣ���ԭ�Ӹ�����Ϊ14��4��5��1��1��C��Dͬ������ԭ������DΪC��2����C����Ԫ�ء�D����Ԫ�أ�EԪ�ص���Χ�����Ų�ʽΪ(n��1)dn��6ns1����n+6=10����n=4������Χ�����Ų�Ϊ3d104sl����E��ͭԪ�أ��ʸ�����ɫ����Ӧ����[Cu(NH3)4]2+��SO42-�����ԭ��������֪AΪH��BΪN����ԭ����Ŀ֮�ȿ�֪��������ﺬ��1���ᾧˮ�����仯ѧʽΪ:[Cu(NH3)4]SO4![]() H2O��
H2O��
(1)������������֪��Ԫ��B��C��DԪ�طֱ���N��O��S��ͬ�������϶��µ�һ�����ܼ�С����OԪ�ص�һ�����ܴ���SԪ�أ�O��NԪ��ͬ���ڣ�NԪ��ԭ��2p�ܼ�����3�����ӣ�Ϊ�����ȶ�״̬�������ϵͣ���һ�����ܴ���OԪ�أ��ʵ�һ�������ɴ�С������˳��Ϊ:N��O��S��(2)DΪSԪ�أ���ԭ�ӵ��������6�����ӣ������Ų�ͼΪ![]() ����3������λ������Ļ�ѧʽΪ[Cu(NH3)4]SO4
����3������λ������Ļ�ѧʽΪ[Cu(NH3)4]SO4![]() H2O��������NH3,����ԭ�ӵļ۵��Ӷ���=
H2O��������NH3,����ԭ�ӵļ۵��Ӷ���=![]() �����Ե�ԭ���ӻ���ʽΪΪsp3�ӻ�����4��OԪ�ؿ���HԪ���γɵ�ԭ�Ӹ����ȷֱ�Ϊ1��1��1��2�Ļ�����ֱ���H2O2��H2O��H2O2������H2O����֮���γ�������������ֻ������������Ȼ�������5��HԪ����NԪ�ؿ��γ�N2H2�����Ӿ���ƽ��ṹ��������ṹʽΪH��N=N��H������ȫ�ǦҼ���˫������1���Ҽ���1���м���N2H2�����к���3���Ҽ���1���м���
�����Ե�ԭ���ӻ���ʽΪΪsp3�ӻ�����4��OԪ�ؿ���HԪ���γɵ�ԭ�Ӹ����ȷֱ�Ϊ1��1��1��2�Ļ�����ֱ���H2O2��H2O��H2O2������H2O����֮���γ�������������ֻ������������Ȼ�������5��HԪ����NԪ�ؿ��γ�N2H2�����Ӿ���ƽ��ṹ��������ṹʽΪH��N=N��H������ȫ�ǦҼ���˫������1���Ҽ���1���м���N2H2�����к���3���Ҽ���1���м���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£�lmolCH3OH��һ����O2������Ӧʱ������CO��CO2��HCHO�������仯����ͼ��ʾ[��Ӧ��O2(g)��������H2O(g)����ȥ]��

�ش��������⣺
(1)���д��������£�CH3 OH��O2��Ӧ��Ҫ���� ___���CO2��CO��HCHO���������㣺2HCHO(g)+O2(g)=2CO(g)+2H2O(g)![]() =_____________
=_____________
(2)��֪��CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g) ![]()
�پ��ⶨ��ͬ�¶��¸÷�Ӧ��ƽ�ⳣ�����£�

�÷�ӦΪ ___������ȡ������ȡ�����Ӧ��250��ʱ��ijʱ�̲�ø÷�Ӧ�ķ�Ӧ����������Ũ��Ϊc(CO) =0��4mol/L��c(H2) =0. 4mol/L��c(CH3 OH) =0. 8mol/L�����ʱ��������____�����棩���>������=����<������
��ij�¶��£�������̶���2L�ܱ������н�1molCO��2molH2��ϣ�ʹ��Ӧ�õ�ƽ�⣬ʵ����ƽ��ʱ����ʼʱ������ѹǿ��ֵΪ0 .7����÷�Ӧ��ƽ�ⳣ��Ϊ____������lλС������
(3)�����Ƽ�ѭ�����ɳ�ȥSO2�������£�������Һ����һ����SO2�����Һ�У�n��SO32-����n(HSO3-) =3��2�����ʱ��Һ��____������ԡ��������ԡ����ԡ���������֪��H2SO3�ĵ��볣��Ϊ��Kal=l. 54��10-2��Ka2=l. 02��l0-7��
(4)���õ绯ѧ��������ҵβ��SO2��װ����ͼ��ʾ��д��Pt(2)�缫��Ӧʽ��______������·��ת��0. 02 mol e-ʱ����ŨH2SO4��δ�ų���������Ĥ�����Һ��Լ����___ mol���ӡ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2001����ΰ��Ļ�ѧ�ҡ�1954��ŵ������ѧ�������������Ļ�ѧ�ṹ��ʦ��20���͵Ŀ�ѧ�ֽܱ���(L.Pauling)���ڵĵ���100���ꡣ1994����λ����л�������Ǵ����İ칫�ң�����������һ��ڰ壬���������ģ�����һ���ṹʽ��ͼ��ʾ������Ϊʲô������ṹʽ�����ܺϳ�������ʲô���ʣ����ö�֪�����DZ����������˵�һ���գ�Ҳ��������Զ������գ�Ҳ���г�һ������ܽ�������ܽ����Σ��������ȶ�����ṹ��һ���˽⡣

(1)���ķ���ʽ��__________________________________________________________��
(2)��������ԭ���Ƿ���ܴ���ͬһ��ƽ���ϣ�________(����ܡ������ܡ�)��
(3)���Ƿ���е�ɣ�________(��ǡ���)��
(4)�÷�����sp�ӻ��ĵ�ԭ����___����sp2�ӻ��ĵ�ԭ����___����sp3�ӻ��ĵ�ԭ����_____����
(5)Ϊʲô�����Ʋ�����ըҩ��______________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ʵ���Ҫ���������ʽṹ����ش��������⣮
(1)��֪A��BΪ��������Ԫ�أ���ԭ�ӵĵ�һ�����ĵ��������±���ʾ��

��A�Ļ��ϼ�__B�Ļ��ϼ�(��������������������=��)��
(2)ʵ��֤����KCl��MgO��CaO��TiN��4�־���Ľṹ��NaCl����ṹ����(��ͼ��ʾ)������3�����Ӿ���ľ������������±���


��� 4�����Ӿ���(������NaCl)�۵�Ӹߵ��͵�˳���ǣ�__��
(3)���������Ӻ�δ�ɶԵ���Խ�࣬�����Խ�ż�¼����Խ�ã�������������V2O5��CrO2�У��ʺ���¼�����ŷ�ԭ�ϵ���___________________________.
(4)ij�����ķ��ӽṹ��ͼ��ʾ����Nԭ�ӵ��ӻ���ʽΪ__����̬Niԭ�ӵĵ����Ų�ʽ__��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ��Cl��Ũ����50 mL 1 mol��L��1AlCl3��Һ��Cl��Ũ����ȵ���(����)
A. 150 mL 1 mol��L��1��NaCl��ҺB. 75 mL 2 mol��L��1NH4Cl��Һ
C. 150 mL 2 mol��L��1��KCl��ҺD. 100 mL 1.5mol��L��1��MgCl2��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ�ǻ������л�����ԭ�ϡ�����ϩ�ͳ������л���ɺϳ�һ���������Ϻ�һ����ȩ�����ϣ�����ϳ�·����ͼ��ʾ(���ַ�Ӧ������ȥ)��

��֪��![]()
![]() 2ROH+
2ROH+![]() ���ش���������
���ش���������
(1)![]() �Ľṹ��ʽΪ_______��
�Ľṹ��ʽΪ_______��![]() �й���������Ϊ__________��
�й���������Ϊ__________��
(2)��![]() Ϊ��ȡ�������廯��������������Ʒ�Ӧ������
Ϊ��ȡ�������廯��������������Ʒ�Ӧ������![]() ������ֻ����1����ԭ�ӣ�
������ֻ����1����ԭ�ӣ�![]() ����Ԫ�ϵ���������ԼΪ13��1������ķ�Ӧ������__________��
����Ԫ�ϵ���������ԼΪ13��1������ķ�Ӧ������__________��
(3)д������ȩ���µ�������Һ��Ӧ�Ļ�ѧ����ʽ��________________��
(4)��д���������������ı���ȩ������ͬ���칹��Ľṹ��ʽ��_____________��
i�����б�����![]() �ṹ
�ṹ
ii���˴Ź���������4��壬�ҷ����֮��Ϊ3��2��2��1
(5)��������![]() Ϊ�����ѵ�ͬϵ�����Է��������ȱ����Ѵ�28������ʹ
Ϊ�����ѵ�ͬϵ�����Է��������ȱ����Ѵ�28������ʹ![]() ��Һ��ɫ��
��Һ��ɫ��![]() ������ͬ���칹�干��________(�����������칹)�֡�
������ͬ���칹�干��________(�����������칹)�֡�
(6)�������еĺϳ�·�ߣ���2���ȱ��龭���²����� ��д��
��д��![]() �ķ�Ӧ����___________��
�ķ�Ӧ����___________��![]() �Ľṹ��ʽ___________��_________________��
�Ľṹ��ʽ___________��_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I. �������ճ������г�����һЩ���ʣ���Һ�ȡ��ھƾ�����CO2������ʯ�ҡ���̼���ơ���ϡ���ᡢ��CaO����Na2O2����Cu������ָ������д�������
��1�����ڼ������������______���ܵ������________��
��2������ˮ�еĵ��뷽��ʽΪ____________��
��3��������������д��һ�����������������Һ��Ӧ�����ӷ���ʽ�� __________��
II. ��ѧ�����ڻ�ѧ��ռ����Ҫ��λ�����ݼ�����գ�
��1��1.204��1022��HCl���ӵ����ʵ���Ϊ______������������ˮ���Ƴ�500 mL����Һ������Һ��Cl�������ʵ���Ũ��Ϊ______��
��2����״�������Ϊ44.8LSO2��______g H2�����ķ�������ͬ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ҹ������������Ĵ�����ӣ���������������˺ܴ����Ⱦ������β��װ��������ڴ�������������������õĹ�����ͼ��ʾ������˵����ȷ���ǣ� ��

A. ��Ӧ��NOΪ��������N2Ϊ��������
B. ����β������Ҫ��Ⱦ�ɷְ���CO��NO��N2
C. NO��O2�����ڴ���������ܷ�Ӧ
D. ��ת���ܻ�ѧ����ʽΪ2NO��O2��4CO ![]() 4CO2��N2
4CO2��N2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ƴ�����Ư����ij��ѧС�����ʵ���Ʊ��������ƣ����������ʷ�����
ʵ��I ��ͼװ���Ʊ�NaC1O2����

��֪����C1O2Ϊ����ɫ���壬������ˮ��Ӧ��
��NaC1O2������Һ�ڵ���38��ʱ����NaC1O2��3H2O���壬����38��ʱ����NaC1O2���壬�¶ȸ���60��ʱNaC1O2�ֽ�����NaC1O3��NaCl��
��1��װ��A��b������������____��a���ܷ���ϡ�������Ũ����____������������������������ԭ����____��
��2��A������C1O2�Ļ�ѧ��Ӧ����ʽΪ____��
��3��C������NaC1O2ʱH2O2��������____��Ϊ��ø����NaC1O2������C������װ�ý��иĽ�����ʩΪ____��
��4����Ӧ�����в���ɴ�Cװ�õ���Һ�л��NaC1O2���壬�벹�����ơ�
i.55��ʱ�����ᾧ ii.__________ ii.��40����ˮϴ�� iv.����60�����õ���Ʒ
ʵ��� ��Ʒ���ʷ���
��5������ʵ�����Ƶõ�NaC1O2�����л����ܺ���������ѧ�����ĺ������Σ��仯ѧʽΪ____��ʵ���пɼ��ٸ����ʲ����IJ�����������____��дһ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com