
【题目】一定条件下,lmolCH3OH与一定量O2发生反应时,生成CO、CO2或HCHO的能量变化如下图所示[反应物O2(g)和生成物H2O(g)已略去]。

回答下列问题:
(1)在有催化剂作用下,CH3 OH与O2反应主要生成 ___(填“CO2、CO或HCHO”);计算:2HCHO(g)+O2(g)=2CO(g)+2H2O(g)![]() =_____________
=_____________
(2)已知:CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g) ![]()
①经测定不同温度下该反应的平衡常数如下:

该反应为 ___(填“放热”或“吸热”)反应;250℃时,某时刻测得该反应的反应物与生成物浓度为c(CO) =0.4mol/L、c(H2) =0. 4mol/L、c(CH3 OH) =0. 8mol/L,则此时υ(正)____υ(逆)(填“>”、“=”或“<”)。
②某温度下,在体积固定的2L密闭容器中将1molCO和2molH2混合,使反应得到平衡,实验测得平衡时与起始时的气体压强比值为0 .7,则该反应的平衡常数为____(保留l位小数)。
(3)利用钠碱循环法可除去SO2。常温下,若吸收液吸收一定量SO2后的溶液中,n(SO32-):n(HSO3-) =3:2,则此时溶液呈____(填“酸性”、“中性”或“碱性”)。(已知:H2SO3的电离常数为:Kal=l. 54×10-2、Ka2=l. 02×l0-7)
(4)利用电化学法处理工业尾气SO2的装置如图所示,写出Pt(2)电极反应式:______;当电路中转移0. 02 mol e-时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加___ mol离子。

【答案】HCHO -470kJ·mol-1 放热 < 2.7 碱性 2HSO3-+2e-+2H+=S2O42-+2H2O 0.03
【解析】
(1)反应速率与活化能的关系,根据图像求反应热;
(2)通过平衡常数的变化判断反应的热效应,通过浓度商判断反应进行的方向;利用压强和三段式计算平衡常数;
(3)利用电离平衡常数求解c(H+);
(4)根据反应类型判断阴、阳极并书写电极反应式,根据电极反应式进行计算。
(1)从图像中可知加入催化剂生成甲醛的反应活化能小,化学反应速率快,所以主要产物为HCHO。根据图像, 1molHCHO转化为1molCO放出的能量为(676-283-158) kJ·mol-1=235 kJ·mol-1,方程式为2molHCHO,则△H需要乘以2,△H=-235×2kJ·mol-1=-470 kJ·mol-1;
(2) ①根据图中数据可知,随着温度的升高,平衡常数降低,平衡逆向移动,逆反应为吸热反应,则正反应为放热反应,该反应为放热反应;对于某时刻,浓度商![]() ,大于250℃的平衡常数2.041,反应逆向进行,正反应速率小于逆反应速率;
,大于250℃的平衡常数2.041,反应逆向进行,正反应速率小于逆反应速率;
②同温同体积的情况下,压强之比等于物质的量之比。平衡时与起始时的气体压强比值为0 .7,开始的物质的量为1mol+2mol=3mol,则平衡时的物质的量为3mol×0.7=2.1mol。
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
开始的物质的量 1 2 0
转化的物质的量 x 2x x
平衡的物质的量 1-x 2-2x x
1-x+2-2x+x=2.1,得x=0.45mol;体积为2L,则有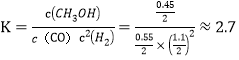 ;
;
(3) n(SO32-):n(HSO3-) =3:2,在同一溶液中,则浓度之比等于物质的量之比,亚硫酸的Ka2=![]() ,得c(H+)=6.8×10-8<10-7,溶液呈碱性;
,得c(H+)=6.8×10-8<10-7,溶液呈碱性;
(4)根据示意图,Pt(2)电极上HSO3-→S2O42-,S的化合价从+4降低到+3,电解质溶液为酸性,则电极方程式为2HSO3-+2e-+2H+=S2O42-+2H2O;Pt(2)为阴极,Pt(1)为阳极,阳极的电极反应式为SO2-2e-+2H2O=SO42-+4H+,电路中通过0. 02 mol e-时,左侧生成0.01molSO42-和0.04molH+,为平衡电荷,有0.02mol的H+经阳离子交换膜转移到右侧,则左侧的离子增加了0.03mol。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】铜是人类最早使用的金属,在生产生活中应用及其广泛。工业上以黄铜矿 (主要成分FeCuS2)为原料制取金属铜,其主要工艺流程如图所示。

已知:反应II的离子方程式:Cu2++CuS+4Cl-=2[CuCl2]-+S
回答下列问题:
(1)FeCuS2中S的化合价____。
(2)反应I在隔绝空气、高温煅烧条件下进行,写出化学方程式____。
(3)为了反应I充分进行,工业上可采取的措施是____。
(4)反应III的离子方程式为____。
(5)向反应III后的溶液中加入稀硫酸的目的是____。
(6)该流程中,可循环利用的物质除CuCl2外,还有___(填化学式)。
(7)反应IV中,处理尾气SO2的方法,合理的是_____
A.高空排放
B.用BaCl2溶液吸收制备BaSO3
C.用氨水吸收后,再经氧化,制备(NH4)2SO4
D.用纯碱溶液吸收可生成Na2SO3(H2CO3:Ka1=4.4×10-7,Ka2=4.7×10-11;H2SO3:Ka1=1.2×102,Ka2=5.6×108)
(8)CuCl悬浊液中加入Na2S,发生的反应为2CuCl(s)+S2-(aq)![]() Cu2S(s)+2Cl-(aq)
Cu2S(s)+2Cl-(aq)
该反应的平衡常数K=___[已知Ksp(CuCl)=a,Ksp(Cu2S)=b]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下图所示装置制备KClO溶液,再用KClO溶液与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4。

已知:Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3;K2FeO4易溶于水、微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定。
回答下列问题:
(1)仪器a的名称___________,装置C中三颈瓶置于冰水浴中的目的是______________________。
(2)装置B吸收的气体是____________(写化学式),装置D的作用是____________________。
(3)装置C中得到足量KClO后,将三颈瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,控制水浴温度为25℃,搅拌1.5 h,溶液变为紫红色(含K2FeO4),反应的离子方程式为____________________。再加入饱和KOH溶液,析出紫黑色晶体,过滤,得到K2FeO4粗产品。
(4)K2FeO4粗产品含有Fe(OH)3、KCl等杂质,其提纯方法为:将一定量的K2FeO4粗产品溶于冷的3 mol·L-1KOH溶液中,过滤,将盛有滤液的烧杯______________________,搅拌、静置、过滤,用乙醇洗涤固体2~3次,最后将固体放在真空干燥箱中干燥。
(5)测定K2FeO4产品纯度。称取K2FeO4产品0.2100 g于烧杯中,加入足量的强碱性亚铬酸盐溶液,反应后再加稀硫酸调节溶液呈强酸性,配成250 mL溶液,取出25.00 mL放入锥形瓶,用0.01000 mol·L-1的(NH4)2Fe(SO4)2溶液滴定至终点,重复操作2次,平均消耗标准溶液30.00 mL[已知:Cr(OH)4-+FeO42-=Fe(OH)3↓+CrO42-+OH-,2CrO42-+2H+=Cr2O72-+H2O,Cr2O72-+6Fe2++14H+=6Fe3++3Cr3++7H2O]。则K2FeO4产品的纯度为_________ %(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2O![]() H++OH-;ΔH>0,下列叙述正确的是
H++OH-;ΔH>0,下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量盐酸,平衡逆向移动,c(OH-)增大
D.将水加热,Kw增大,pH不变,呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院科研团队研究表明,在常温常压和可见光下,基于![]() (一种固体催化剂)合成
(一种固体催化剂)合成![]() 的原理示意图如图。下列说法错误的是
的原理示意图如图。下列说法错误的是

A. 氧化剂与还原剂的物质的量之比为3:1
B. 该过程中涉及极性键和非极性键的断裂与生成
C. 基于![]() 合成
合成![]() 的过程属于氮的固定
的过程属于氮的固定
D. 工业中,氨经一系列反应可以得到硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟化钙材料具有良好的透光性和较低的折射率,可用做紫外和红外光学元件、不可见光谱范围内的消色差镜头。如图为氟化钙晶胞,其中小球代表Ca2+,大球代表F-。
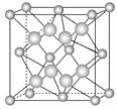
(1)每个晶胞实际含有________个Ca2+和________个F-。
(2)氟化钙晶体可以看作Ca2+按__________堆积排列,F-填入Ca2+堆积的部分空隙中。每个Ca2+周围有__________个F-,而每个F-周围有_________个Ca2+,每个F-周围与其距离最近的F-的数目是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年,元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题。

(1)元素Ga在元素周期表中的位置为:___(写明周期和族)。
(2)Sn的最高正价为___,Cl的最高价氧化物对应水化物的化学式为___,As的气态氢化物为___。
(3)根据元素周期律,推断:
①阴影部分元素氢化物热稳定性最高的是___(填化学式)。
②H3AsO4、H2SeO4的酸性强弱:H3AsO4___H2SeO4(填“>”、“<”或“=”)。
③氢化物的还原性:H2O___H2S(填“>”、“<”或“=”)。
(4)可在图中分界线(虚线部分)附近寻找___(填序号)。
A.优良的催化剂 B.半导体材料 C.合金材料 D.农药
(5)①Se2Cl2常用作分析试剂,其电子式为___。
②硒(Se)化铟(In)是一种可应用于未来超算设备的新型半导体材料。下列说法正确的是___(填字母)。
A.原子半径:In>Se
B.In的金属性比Se强
C.In的金属性比Al弱
D.硒化铟的化学式为InSe2
③工业上常从电冶铜的阳极泥中提取纳米硒。向浆化的阳极泥中通入氯气,Cu2Se被溶液中的HClO氧化为H2SeO3及CuCl2,反应中HClO与Cu2Se的物质的量之比为___。
(6)请设计实验比较C、Si的非金属性强弱顺序(可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、饱和Na2CO3溶液、硅酸钠溶液,化学仪器根据需要选择)。
实验步骤 | 实验现象与结论 |
在试管中加入___,再加入___,将生成气体通过___洗气后,通入___; | 现象:___;结论:非金属性C>Si |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用如下方法制取Cl2,根据相关信息,回答下列问题:
(1)用双线桥法表示电子转移方向和数目_____:①MnO2 +4HCl(浓)=== Cl2↑+ MnCl2+ 2H2O
(2)若反应中有0.1mol的氧化剂被还原,则被氧化的物质为__(填化学式),被氧化的物质的量为 _____,同时转移电子数为_____。
(3)将(2)生成的氯气与 0.2mol H2 完全反应,生成的气体在标准状况下所占体积为_____L,将此产物溶于水配成100mL溶液,此溶液的物质的量浓度为_______。(已知:H2+Cl2![]() 2HCl)
2HCl)
(4)②KClO3+6HCl(浓)===3Cl2↑+KCl+3H2O③2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
若要制得相同质量的氯气,①②③三个反应中电子转移的数目之比为____。
(5)已知反应4HCl(g)+O2 ![]() 2Cl2+2H2O(g),该反应也能制得氯气,则MnO2、O2、KMnO4三种物质氧化性由弱到强的顺序为_______。
2Cl2+2H2O(g),该反应也能制得氯气,则MnO2、O2、KMnO4三种物质氧化性由弱到强的顺序为_______。
(6)将不纯的NaOH样品2.50 g(样品含少量Na2CO3和水),放入50.0 mL 2.00mol/L盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40.0 mL 1.00 mol/L的NaOH溶液。蒸发中和后的溶液,最终得到_____g固体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某配位化合物为深蓝色晶体,由原子序数由小到大的A,B,C,D,E五种元素组成,其原子个数比为14∶4∶5∶1∶1。其中C,D同主族且原子序数D为C的2倍,E元素的外围电子排布式为(n-1)dn+6ns1,试回答下列问题:
(1)元素B,C,D的第一电离能由大到小排列顺序为________(用元素符号表示)。
(2)D元素基态原子的最外层电子排布图为________。
(3)该配位化合物的化学式为________,配体的中心原子的杂化方式为________。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1∶1和1∶2,两种化合物可以任意比互溶,解释其主要原因为_______________。
(5)A元素与B元素可形成分子式为B2A2的某化合物,该化合物的分子具有平面结构,则其结构式为________,分子中含有________个σ键,________个π键。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com