
【题目】氟化钙材料具有良好的透光性和较低的折射率,可用做紫外和红外光学元件、不可见光谱范围内的消色差镜头。如图为氟化钙晶胞,其中小球代表Ca2+,大球代表F-。
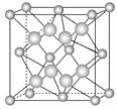
(1)每个晶胞实际含有________个Ca2+和________个F-。
(2)氟化钙晶体可以看作Ca2+按__________堆积排列,F-填入Ca2+堆积的部分空隙中。每个Ca2+周围有__________个F-,而每个F-周围有_________个Ca2+,每个F-周围与其距离最近的F-的数目是________。
【答案】4 8 面心立方 8 4 6
【解析】
(1)利用均摊法分析晶胞中实际含有的粒子个数。
(2)根据晶体堆积模型和晶胞特点分析。
(1)Ca2+占据晶胞的8个顶点和6个面的面心的位置,所以每个晶胞实际含有Ca2+的个数=8×![]() +6×
+6×![]() =4,F-在晶胞内,完全属于该晶胞,所以每个晶胞中实际含有8个F-。
=4,F-在晶胞内,完全属于该晶胞,所以每个晶胞中实际含有8个F-。
(2)由CaF2晶胞示意图可知,Ca2+分布在晶胞的8个顶点和6个面的面心上,根据晶体粒子堆积模型可知,Ca2+是按面心立方堆积排列。将CaF2晶胞分割成8个小立方体,如图 (黑球为Ca2+,白球为F-),每个小立方体的体心是F-,内接正四面体的4个顶点是Ca2+,通过每个顶点的Ca2+有8个小立方体,因此每个Ca2+周围有8个F-,每个F-周期有4个Ca2+。从CaF2晶胞的
(黑球为Ca2+,白球为F-),每个小立方体的体心是F-,内接正四面体的4个顶点是Ca2+,通过每个顶点的Ca2+有8个小立方体,因此每个Ca2+周围有8个F-,每个F-周期有4个Ca2+。从CaF2晶胞的![]() 即小立方体
即小立方体 看,以体心的F-为观察对象,与该F-距离最近的F-处于与该小立方体紧邻的上下左右前后共6个小立方体的体心,所以每个F-周围与其距离最近的F-的数目是为6。
看,以体心的F-为观察对象,与该F-距离最近的F-处于与该小立方体紧邻的上下左右前后共6个小立方体的体心,所以每个F-周围与其距离最近的F-的数目是为6。


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】氮、磷是植物生长所需的重要元素。回答下列问题:
(1)下列N原子电子排布图表示的状态中,能量由低到高的顺序是____(填标号)。

(2)羟氨(NH2OH)可看成是氨分子内的一个氢原子被羟基取代的衍生物,分子中N的杂化类型是___。羟氨易溶于水,其主要原因是____。
(3)第一电离能I1(N)_____I1(P)(填“>”“<”“=”),原因是_____。
(4)直链多磷酸根阴离子是由两个或两个以上磷氧四面体通过共用顶角氧原子连接起来的,如图所示。则由n个磷氧四面体形成的这类磷酸根离子的通式为_____。

(5)氮化锗具有耐腐蚀、硬度高等优点,晶体中锗原子与氮原子之间存在明显的s-p杂化现象,氮化锗晶体属于______晶体。一种氮化锗晶胞的球棍模型如图,其化学式为_____,若晶胞长方体的高为bpm,阿伏加德罗常数值为NA,晶体的密度为ρ g/cm3,则晶胞底面正方形的边长为_______ pm(列出计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列五种元素的电离能数据(单位:kJ·mol-1),回答下列各题。

(1)在周期表中,最可能处于同一族的是________(填字母,下同)。
A.Q和R B.S和T C.T和U D.R和T E.R和U
(2)它们的氯化物的化学式,最可能正确的是________。
A.QCl2 B.RCl C.SCl3 D.TCl E.UCl4
(3)S元素最可能是________。
A.s区元素 B.稀有气体元素 C.p区元素 D.准金属 E.d区元素
(4)下列元素中,化学性质和物理性质最像Q元素的是________。
A.硼(1s22s22p1) B.铍(1s22s2) C.锂(1s22s1) D.氢(1s1) E.氦(1s2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有14.4gCO和CO2的混合气体,在标准状况下其体积为8.96L。
(1)将混合气体依次通过下列如图所示装置,最后收集在气球中(实验在标准状况下测定)。

①气球中收集到的气体的摩尔质量为___。
②收集到气球中的气体的电子总数为____(用NA表示阿伏加德罗常数的值)。
(2)求该混合气体的平均摩尔质量(要有计算过程)___
(3)求混合气体中碳原子的个数(用NA表示阿伏加德罗常数的值,且要有计算过程)。___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,lmolCH3OH与一定量O2发生反应时,生成CO、CO2或HCHO的能量变化如下图所示[反应物O2(g)和生成物H2O(g)已略去]。

回答下列问题:
(1)在有催化剂作用下,CH3 OH与O2反应主要生成 ___(填“CO2、CO或HCHO”);计算:2HCHO(g)+O2(g)=2CO(g)+2H2O(g)![]() =_____________
=_____________
(2)已知:CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g) ![]()
①经测定不同温度下该反应的平衡常数如下:

该反应为 ___(填“放热”或“吸热”)反应;250℃时,某时刻测得该反应的反应物与生成物浓度为c(CO) =0.4mol/L、c(H2) =0. 4mol/L、c(CH3 OH) =0. 8mol/L,则此时υ(正)____υ(逆)(填“>”、“=”或“<”)。
②某温度下,在体积固定的2L密闭容器中将1molCO和2molH2混合,使反应得到平衡,实验测得平衡时与起始时的气体压强比值为0 .7,则该反应的平衡常数为____(保留l位小数)。
(3)利用钠碱循环法可除去SO2。常温下,若吸收液吸收一定量SO2后的溶液中,n(SO32-):n(HSO3-) =3:2,则此时溶液呈____(填“酸性”、“中性”或“碱性”)。(已知:H2SO3的电离常数为:Kal=l. 54×10-2、Ka2=l. 02×l0-7)
(4)利用电化学法处理工业尾气SO2的装置如图所示,写出Pt(2)电极反应式:______;当电路中转移0. 02 mol e-时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加___ mol离子。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. NO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构
B. P4和CH4都是正四面体型分子且键角都为109.5°
C. NH4+的电子式为 ,离子呈平面正方形结构
,离子呈平面正方形结构
D. NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机化合物的说法正确的是
A. 麦芽糖的水解产物有两种,且互为同分异构体
B. 等质量的苯和苯乙烯完全燃烧,消耗氧气的体积在相同条件下不相同
C. 间二甲苯中苯环上的一个氢原子被“![]() ”取代时,有9种结构(不考虑立体异构)
”取代时,有9种结构(不考虑立体异构)
D. ![]() 与甲苯或甘油在一定条件下发生反应,其反应类型不同
与甲苯或甘油在一定条件下发生反应,其反应类型不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下联氨(![]() )的水溶液中有:① N2H4+H2O
)的水溶液中有:① N2H4+H2O![]() N2H5++OH- K1
N2H5++OH- K1
② N2H5++H2O![]() N2H62++OH- K2,该溶液中微粒的物质的量分数
N2H62++OH- K2,该溶液中微粒的物质的量分数![]() 随
随![]() 变化的关系如图所示。下列叙述错误的是
变化的关系如图所示。下列叙述错误的是

A. 图中Ⅲ对应的液粒为![]()
B. 由图可知,![]()
C. 若![]() 点为
点为![]() 溶液,则存在:
溶液,则存在:![]()
D. 反应②为![]() 的水解方程式
的水解方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是基本的有机化工原料。用乙烯和常见的有机物可合成一种醚类香料和一种缩醛类香料,具体合成路线如图所示(部分反应条件略去):

已知:![]()
![]() 2ROH+
2ROH+![]() ,回答下列问题
,回答下列问题
(1)![]() 的结构简式为_______,
的结构简式为_______,![]() 中官能团名称为__________。
中官能团名称为__________。
(2)若![]() 为单取代芳香族化合物且能与金属钠反应;毎个
为单取代芳香族化合物且能与金属钠反应;毎个![]() 分子中只含有1个氧原子,
分子中只含有1个氧原子,![]() 中氧元紫的质量分数约为13.1%,则⑥的反应类型是__________。
中氧元紫的质量分数约为13.1%,则⑥的反应类型是__________。
(3)写出苯乙醛与新的银氨溶液反应的化学方程式:________________。
(4)请写出满足下列条件的苯乙醛的所有同分异构体的结构简式:_____________。
i.含有苯环和![]() 结构
结构
ii.核磁共振氢谱有4组峰,且峰面积之比为3:2:2:1
(5)若化合物![]() 为苯甲醚的同系物,且相对分子质量比苯甲醚大28,则能使
为苯甲醚的同系物,且相对分子质量比苯甲醚大28,则能使![]() 溶液显色的
溶液显色的![]() 的所有同分异构体共有________(不考虑立体异构)种。
的所有同分异构体共有________(不考虑立体异构)种。
(6)参照题中的合成路线,由2-氯丙烷经如下步骤制 。写出
。写出![]() 的反应条件___________,
的反应条件___________,![]() 的结构简式___________,_________________。
的结构简式___________,_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com