
【题目】I. 以下是日常生活中常见的一些物质:①液氯、②酒精、③CO2、④熟石灰、⑤碳酸钠、⑥稀盐酸、⑦CaO、⑧Na2O2、⑨Cu,请你指出(填写序号):
(1)属于碱性氧化物的是______;能导电的是________。
(2)⑤在水中的电离方程式为____________。
(3)根据以上物质写出一个酸性氧化物与碱溶液反应的离子方程式: __________。
II. 化学计量在化学中占有重要地位.根据计算填空:
(1)1.204×1022个HCl分子的物质的量为______,该气体溶于水配制成500 mL的溶液,则溶液中Cl﹣的物质的量浓度为______。
(2)标准状况下体积为44.8LSO2与______g H2所含的分子数相同。
【答案】⑦ ⑥⑨ Na2CO3=2Na++CO32- Ca2++ 2 OH-+CO2![]() CaCO3↓+H2O 0.02 mol 0.04 mol·L-1 4
CaCO3↓+H2O 0.02 mol 0.04 mol·L-1 4
【解析】
I. ①液氯属于非金属单质,不能导电;
②酒精是非电解质,不能导电;
③CO2是酸性氧化物,属于非电解质,不能导电;
④熟石灰的主要成分氢氧化钙是碱,属于电解质,熟石灰中没有自由移动的离子,不能导电;
⑤碳酸钠是盐,属于电解质,碳酸钠中没有自由移动的离子,不能导电;
⑥稀盐酸为混合物,溶液中存在自由移动的离子,能导电;
⑦CaO是碱性氧化物,属于电解质,CaO中没有自由移动的离子,不能导电;
⑧Na2O2是过氧化物,属于电解质,Na2O2中没有自由移动的离子,不能导电;
⑨Cu属于金属单质,能导电;
(1)属于碱性氧化物的是CaO,能导电的是稀盐酸和铜,故答案为:⑦;⑥⑨;
(2)碳酸钠为强电解质,在溶液中完全电离出钠离子和碳酸根离子,电离方程式为Na2CO3=2Na++CO32-,故答案为:Na2CO3=2Na++CO32-;
(3)题中酸性氧化物为CO2,碱为Ca(OH)2,两者反应的离子方程式为CO2+Ca2++2OH-=CaCO3↓+H2O,故答案为:CO2+Ca2++2OH-=CaCO3↓+H2O。
II. (1)1.204×1022个HCl分子的物质的量为![]() =0.02 mol,氯化氢气体溶于水形成盐酸,氯化氢是强电解质,在溶液中完全电离,则500 mL中Cl﹣的物质的量浓度为
=0.02 mol,氯化氢气体溶于水形成盐酸,氯化氢是强电解质,在溶液中完全电离,则500 mL中Cl﹣的物质的量浓度为![]() = 0.04 mol/L,故答案为:0.02 mol;0.04 mol/L;
= 0.04 mol/L,故答案为:0.02 mol;0.04 mol/L;
(2)标准状况下体积为44.8LSO2的物质的量为![]() =2 mol,与二氧化硫分子数相同的氢气的物质的量为2 mol,2 mol氢气的质量为2 mol×2g/mol=4g,故答案为:4。
=2 mol,与二氧化硫分子数相同的氢气的物质的量为2 mol,2 mol氢气的质量为2 mol×2g/mol=4g,故答案为:4。


科目:高中化学 来源: 题型:
【题目】1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年,元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题。

(1)元素Ga在元素周期表中的位置为:___(写明周期和族)。
(2)Sn的最高正价为___,Cl的最高价氧化物对应水化物的化学式为___,As的气态氢化物为___。
(3)根据元素周期律,推断:
①阴影部分元素氢化物热稳定性最高的是___(填化学式)。
②H3AsO4、H2SeO4的酸性强弱:H3AsO4___H2SeO4(填“>”、“<”或“=”)。
③氢化物的还原性:H2O___H2S(填“>”、“<”或“=”)。
(4)可在图中分界线(虚线部分)附近寻找___(填序号)。
A.优良的催化剂 B.半导体材料 C.合金材料 D.农药
(5)①Se2Cl2常用作分析试剂,其电子式为___。
②硒(Se)化铟(In)是一种可应用于未来超算设备的新型半导体材料。下列说法正确的是___(填字母)。
A.原子半径:In>Se
B.In的金属性比Se强
C.In的金属性比Al弱
D.硒化铟的化学式为InSe2
③工业上常从电冶铜的阳极泥中提取纳米硒。向浆化的阳极泥中通入氯气,Cu2Se被溶液中的HClO氧化为H2SeO3及CuCl2,反应中HClO与Cu2Se的物质的量之比为___。
(6)请设计实验比较C、Si的非金属性强弱顺序(可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、饱和Na2CO3溶液、硅酸钠溶液,化学仪器根据需要选择)。
实验步骤 | 实验现象与结论 |
在试管中加入___,再加入___,将生成气体通过___洗气后,通入___; | 现象:___;结论:非金属性C>Si |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D(放置有铁粉)。请回答:
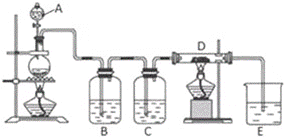
(1)仪器A的名称是____,烧瓶中反应的化学方程式是____。其中盐酸具有___(填序号)
①氧化性 ②还原性 ③酸性
(2)装置B中盛放液体是___,气体通过装置B的目的是___。装置C中盛放的液体是___。
(3)D中反应的化学方程式是____。
(4)烧杯E中盛放的液体是___,作用是___,反应的离子方程式是___。
(5)资料表明D中产物有以下性质:①受热易升华,冷却后易凝华;②遇H2O(g)剧烈反应。为收集D中产物,在D与E之间,除增加收集装置外,还需要增加___装置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某配位化合物为深蓝色晶体,由原子序数由小到大的A,B,C,D,E五种元素组成,其原子个数比为14∶4∶5∶1∶1。其中C,D同主族且原子序数D为C的2倍,E元素的外围电子排布式为(n-1)dn+6ns1,试回答下列问题:
(1)元素B,C,D的第一电离能由大到小排列顺序为________(用元素符号表示)。
(2)D元素基态原子的最外层电子排布图为________。
(3)该配位化合物的化学式为________,配体的中心原子的杂化方式为________。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1∶1和1∶2,两种化合物可以任意比互溶,解释其主要原因为_______________。
(5)A元素与B元素可形成分子式为B2A2的某化合物,该化合物的分子具有平面结构,则其结构式为________,分子中含有________个σ键,________个π键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年,一些药物引起的不良反应引起了人们的关注。因此在开发新药时如何减少毒副作用是一个很重要的课题。在下列结构简式中,Ⅰ是扑热息痛,Ⅱ是阿司匹林,它们都是临床应用广泛的解热镇痛药,但Ⅰ易导致肾脏中毒,Ⅱ对胃黏膜有刺激性,多用会引起胃溃疡。Ⅲ是扑炎痛,它是根据药物合成中“拼合原理”的方法,设计并合成出的解热镇痛药。这三种物质的结构简式如下:

试回答:
(1)为什么阿司匹林会有上述的毒副作用?___________
(2)合成扑炎痛的反应属于有机化学中的哪一类反应?_________
(3)扑炎痛本身并无解热镇痛的功效,但口服进入人体内后会产生上述药理作用,且毒副作用没有Ⅰ和Ⅱ那么明显,试加以解_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NA表示阿伏加德罗常数,则关于热化学方程式:
C2H2(g)+![]() O2(g)===2CO2(g)+H2O(l) ΔH=-1300 kJ/mol的说法中,正确的是( )
O2(g)===2CO2(g)+H2O(l) ΔH=-1300 kJ/mol的说法中,正确的是( )
A. 当有6 NA个电子转移时,该反应放出1300 kJ的能量
B. 当有1NA个水分子生成且为液体时,吸收1300 kJ的能量
C. 当有4NA个碳氧共用电子对生成时,放出1300 kJ的能量
D. 当有8NA个碳氧共用电子对生成时,放出1300 kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若反应:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH<0在恒温、恒容的密闭体系中进行,下列示意图正确且能说明该反应在进行到t1时刻达到平衡状态的是( )
2CO2(g)+N2(g) ΔH<0在恒温、恒容的密闭体系中进行,下列示意图正确且能说明该反应在进行到t1时刻达到平衡状态的是( )
A.  B.
B. 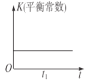 C.
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃将浓度均为0.1 mol/L的HA溶液和BOH溶液按体积分别为Va和Vb混合,保持Va+Vb=100 mL,且生成的BA可溶于水。已知Va、Vb与混合液pH关系如图。下列说法错误的是

A. 曲线II表示HA溶液体积
B. x点存在c(A-)+c(OH-)=c(B+)+c(H+)
C. 电离平衡常数K(HA)>K(BOH)
D. 向z点溶液加入NaOH,水的电离程度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)![]() 2SO3(g);正反应放热。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是:
2SO3(g);正反应放热。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是:

A. 图I研究的是t0时刻增大O2的浓度对反应速率的影响
B. 图II研究的是t0时刻加入催化剂后对反应速率的影响
C. 图III研究的是催化剂对平衡的影响,且甲的催化效率比乙高
D. 图III研究的是温度对化学平衡的影响,且甲的温度较高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com