
【题目】若反应:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH<0在恒温、恒容的密闭体系中进行,下列示意图正确且能说明该反应在进行到t1时刻达到平衡状态的是( )
2CO2(g)+N2(g) ΔH<0在恒温、恒容的密闭体系中进行,下列示意图正确且能说明该反应在进行到t1时刻达到平衡状态的是( )
A.  B.
B. 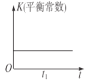 C.
C.  D.
D. 
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】下列关于晶体的说法一定正确的是( )

(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶点)
A. 分子晶体中都存在共价键
B. CaTiO3晶体中每个Ti4+和12个O2-相紧邻
C. SiO2晶体中每个硅原子与两个氧原子以共价键相结合
D. 金属晶体的熔点都比分子晶体的熔点高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中Cl-浓度与50 mL 1 mol·L-1AlCl3溶液中Cl-浓度相等的是( )
A. 150 mL 1 mol·L-1的NaCl溶液B. 75 mL 2 mol·L-1NH4Cl溶液
C. 150 mL 2 mol·L-1的KCl溶液D. 100 mL 1.5mol·L-1的MgCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 以下是日常生活中常见的一些物质:①液氯、②酒精、③CO2、④熟石灰、⑤碳酸钠、⑥稀盐酸、⑦CaO、⑧Na2O2、⑨Cu,请你指出(填写序号):
(1)属于碱性氧化物的是______;能导电的是________。
(2)⑤在水中的电离方程式为____________。
(3)根据以上物质写出一个酸性氧化物与碱溶液反应的离子方程式: __________。
II. 化学计量在化学中占有重要地位.根据计算填空:
(1)1.204×1022个HCl分子的物质的量为______,该气体溶于水配制成500 mL的溶液,则溶液中Cl﹣的物质的量浓度为______。
(2)标准状况下体积为44.8LSO2与______g H2所含的分子数相同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲型H1N1流感病毒曾在全球广泛传播,给人类健康、社会经济带来了巨大的负面影响。我国采取积极应对措施,使病毒得到了有效的控制,从很大程度上减少了损失,在这里,消毒液功不可没。
(1)生产消毒液是将氯气通入NaOH溶液中,该反应的离子方程式为________。
(2)取少量消毒液滴加AgNO3溶液,现象是出现白色沉淀,说明消毒液中有____离子(写离子符号),该反应的的离子方程式为____________。
(3)消毒液稀释后喷洒在空气中,可以生成具有漂白性的物质,该物质为_________;该物质有漂白性是因为它有强的氧化性,但是它也很不稳定,写出它分解反应的化学方程式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着我国汽车年销量的大幅增加,给空气环境造成了很大的污染。汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )

A. 反应中NO为氧化剂,N2为氧化产物
B. 汽车尾气的主要污染成分包括CO、NO和N2
C. NO和O2必须在催化剂表面才能反应
D. 催化转化总化学方程式为2NO+O2+4CO ![]() 4CO2+N2
4CO2+N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1 L容器中用O2将HCl转化为Cl2,反应方程式为:4HCl(g)+O2(g)![]() 2H2O(g)+2Cl2(g) ΔH<0,一定条件下测得反应过程中n(Cl2)的实验数据如下。下列说法正确的是( )
2H2O(g)+2Cl2(g) ΔH<0,一定条件下测得反应过程中n(Cl2)的实验数据如下。下列说法正确的是( )
t/min | 0 | 2 | 4 | 6 |
n(Cl2)/10-3 mol | 0 | 1.8 | 3.7 | 5.4 |
A. 0~2 min的反应速率小于4~6 min的反应速率
B. 2~6 min用Cl2表示的反应速率为0.9 mol/(L·min)
C. 增大压强可以提高HCl转化率
D. 平衡常数K(200 ℃)<K(400 ℃)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某高能锂离子电池的总反应为:2Li+FeS= Fe +Li2S,电解液为含LiPF6.SO(CH3)2的有机溶液(Li+可自由通过)。某小组以该电池为电源电解废水并获得单质镍,工作原理如图所示。

下列分析正确的是
A. 该锂离子电池正极反应为FeS+2Li++2e-=Fe +Li2S
B. X与电池的Li电极相连
C. 电解过程中c(BaC12)保持不变
D. 若去掉阳离子膜将左右两室合并,则X电极的反应不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和深度开发CO、CO2的应用具有重要的社会意义。回答下列问题:
Ⅰ.CO可用于高炉炼铁,已知:
Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g) △H1=a kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H2=b kJ/mol
则反应Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)的△H3=________kJ/mol(用含a、b的代数式表示)。
Ⅱ.一定条件下,CO2和CO可以互相转化。
(1)某温度下,在容积为2L的密闭容器按甲、乙两种方式投入反应物发生反应:CO2(g)+H2(g)![]() CO(g)+H2O(g)。
CO(g)+H2O(g)。
容器 | 反应物 |
甲 | 8 mol CO2(g)、16 mol H2(g) |
乙 | w mol CO2(g)、x mol H2(g)、y mol CO(g)、z mol H2O(g) |
甲容器15 min后达到平衡,此时CO2的转化率为75%。则0~15 min内平均反应速率v(H2)=______,此条件下该反应的平衡常数K=______。
欲使平衡后乙与甲中相同组分气体的体积分数相等,则w、x、y、z需满足的关系是:y______z(填“>”、“<”或“=”),且y=______(用含x、w的等式表示)。
(2)研究表明,温度、压强对反应“C6H5CH2CH3(g)+CO2(g)![]() C6H5CH=H2(g)+CO(g) +H2O(g) △H ”中乙苯的平衡转化率影响如图所示:
C6H5CH=H2(g)+CO(g) +H2O(g) △H ”中乙苯的平衡转化率影响如图所示:

则△H_____0(填“>”、“<”或“=”),压强p1、p2、p3从大到小的顺序是________。
(3)CO可被NO2氧化:CO+NO2![]() CO2+NO。当温度高于225℃时,反应速率v 正=k正·c(CO)·c(NO2)、v逆=k逆·c(CO2)·c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为________。
CO2+NO。当温度高于225℃时,反应速率v 正=k正·c(CO)·c(NO2)、v逆=k逆·c(CO2)·c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com