
����Ŀ�����ݻ�������ܱ������д������·�Ӧ��2SO2(g)��O2(g)![]() 2SO3(g)������Ӧ���ȡ�ij�о�С���о���������������ʱ���ı�ijһ������������Ӧ��Ӱ�죬���з�����ȷ���ǣ�
2SO3(g)������Ӧ���ȡ�ij�о�С���о���������������ʱ���ı�ijһ������������Ӧ��Ӱ�죬���з�����ȷ���ǣ�

A. ͼI�о�����t0ʱ������O2��Ũ�ȶԷ�Ӧ���ʵ�Ӱ��
B. ͼII�о�����t0ʱ�̼��������Է�Ӧ���ʵ�Ӱ��
C. ͼIII�о����Ǵ�����ƽ���Ӱ�죬�ҼĴ�Ч�ʱ��Ҹ�
D. ͼIII�о������¶ȶԻ�ѧƽ���Ӱ�죬�Ҽ��¶Ƚϸ�
���𰸡�B
��������
A������Ӧ���Ũ�ȣ����淴Ӧ���ʾ�������������Ӧ���������˲�䣬�淴Ӧ���ʲ��䣻
B������ֻ�ı䷴Ӧ���ʣ���Ӱ��ƽ���ƶ���
C��������Ӱ��ƽ���ƶ����������SO2 ��ת���ʲ��䣻
D�����ȹ���ƽ��ֵ�������ʱƽ���������ƶ�������
A������Ӧ���Ũ�ȣ����淴Ӧ���ʾ�������������Ӧ���������˲�䣬�淴Ӧ���ʲ��䣬�����淴Ӧ������t0ʱ�̲��䣬�����뿪ԭƽ��㣬��A����
B��������Ӱ��ƽ���ƶ������Լӿ췴Ӧ���ʣ���B��ȷ��
C��������Ӱ��ƽ���ƶ����������SO2 ��ת���ʲ��䣬��C������
D���ȹ���ƽ��ֵ��˵���ҵ��¶ȸ��ڼף�����ƽ�������ƶ���SO2��ת���ʽ��ͣ���D����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I. �������ճ������г�����һЩ���ʣ���Һ�ȡ��ھƾ�����CO2������ʯ�ҡ���̼���ơ���ϡ���ᡢ��CaO����Na2O2����Cu������ָ������д�������
��1�����ڼ������������______���ܵ������________��
��2������ˮ�еĵ��뷽��ʽΪ____________��
��3��������������д��һ�����������������Һ��Ӧ�����ӷ���ʽ�� __________��
II. ��ѧ�����ڻ�ѧ��ռ����Ҫ��λ�����ݼ�����գ�
��1��1.204��1022��HCl���ӵ����ʵ���Ϊ______������������ˮ���Ƴ�500 mL����Һ������Һ��Cl�������ʵ���Ũ��Ϊ______��
��2����״�������Ϊ44.8LSO2��______g H2�����ķ�������ͬ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij��������ӵ�ص��ܷ�ӦΪ��2Li+FeS= Fe +Li2S�����ҺΪ��LiPF6��SO(CH3)2���л���Һ��Li+������ͨ������ijС���Ըõ��Ϊ��Դ����ˮ����õ�����������ԭ����ͼ��ʾ��

���з�����ȷ����
A. ������ӵ��������ӦΪFeS+2Li++2e-=Fe +Li2S
B. X���ص�Li�缫����
C. ��������c(BaC12)���ֲ���
D. ��ȥ��������Ĥ���������Һϲ�����X�缫�ķ�Ӧ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ƴ�����Ư����ij��ѧС�����ʵ���Ʊ��������ƣ����������ʷ�����
ʵ��I ��ͼװ���Ʊ�NaC1O2����

��֪����C1O2Ϊ����ɫ���壬������ˮ��Ӧ��
��NaC1O2������Һ�ڵ���38��ʱ����NaC1O2��3H2O���壬����38��ʱ����NaC1O2���壬�¶ȸ���60��ʱNaC1O2�ֽ�����NaC1O3��NaCl��
��1��װ��A��b������������____��a���ܷ���ϡ�������Ũ����____������������������������ԭ����____��
��2��A������C1O2�Ļ�ѧ��Ӧ����ʽΪ____��
��3��C������NaC1O2ʱH2O2��������____��Ϊ��ø����NaC1O2������C������װ�ý��иĽ�����ʩΪ____��
��4����Ӧ�����в���ɴ�Cװ�õ���Һ�л��NaC1O2���壬�벹�����ơ�
i.55��ʱ�����ᾧ ii.__________ ii.��40����ˮϴ�� iv.����60�����õ���Ʒ
ʵ��� ��Ʒ���ʷ���
��5������ʵ�����Ƶõ�NaC1O2�����л����ܺ���������ѧ�����ĺ������Σ��仯ѧʽΪ____��ʵ���пɼ��ٸ����ʲ����IJ�����������____��дһ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʯī������C����LiFePO4������ɵ�����ӵ�صĹ���ԭ����ͼ��ʾ��ʵ���������������ǽ���������ӵ���Ĥ���ߵģ�����ŵ�ʱ��Li+��������������Ƕ��Ƕ�룬��֮��ʯī�з�����LixC6��������롣����˵����ȷ����
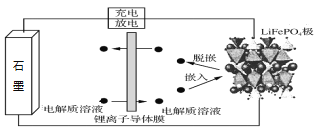
A. ����ӵ���ĤӦ�б�����Ʒ��ذ�ȫ�Ե�����
B. �õ�ع���������FeԪ�ػ��ϼ�û�з����仯
C. �ŵ�ʱ�����������ϵķ�ӦΪ6C+xLi++ xe- =LixC6
D. �ŵ�ʱ�����������ϵķ�ӦΪLiFePO4 - xe- = Li1-xFePO4 + xLi+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���Ҵ����ϴ���FeBr3��Һ���õ���ı���Һ����ˮFeCl3����������ܴﵽ��Ӧʵ��Ŀ�ĵ���
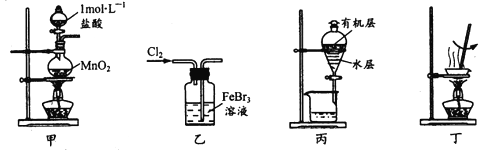
A. ��װ�ü���ȡ����
B. ��װ����ʹBr�� ȫ��ת��Ϊ�嵥��
C. ��װ�ñ���Һʱ�ȴ��¿ڷų�ˮ�㣬�ٴ��Ͽڵ����л���
D. ��װ�ö�����Һ���ˮ���������ɣ��������Ƶ���ˮFeCl3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�����ȿ���CO��CO2��Ӧ�þ�����Ҫ��������塣�ش��������⣺
����CO�����ڸ�¯��������֪��
Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g) ��H1=a kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ��H2=b kJ/mol
��ӦFe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)����H3=________kJ/mol���ú�a��b�Ĵ���ʽ��ʾ����
����һ�������£�CO2��CO���Ի���ת����
��1��ij�¶��£����ݻ�Ϊ2L���ܱ��������ס������ַ�ʽͶ�뷴Ӧ�����Ӧ��CO2(g)+H2(g)![]() CO(g)+H2O(g)��
CO(g)+H2O(g)��
���� | ��Ӧ�� |
�� | 8 mol CO2(g)��16 mol H2(g) |
�� | w mol CO2(g)��x mol H2(g)��y mol CO(g)��z mol H2O(g) |
������15 min��ﵽƽ�⣬��ʱCO2��ת����Ϊ75%����0~15 min��ƽ����Ӧ����v(H2)=______���������¸÷�Ӧ��ƽ�ⳣ��K=______��
��ʹƽ������������ͬ�����������������ȣ���w��x��y��z������Ĺ�ϵ�ǣ�y______z�����������������=��������y=______���ú�x��w�ĵ�ʽ��ʾ����
��2���о��������¶ȡ�ѹǿ�Է�Ӧ��C6H5CH2CH3(g)+CO2(g)![]() C6H5CH=H2(g)+CO(g) +H2O(g) ��H �����ұ���ƽ��ת����Ӱ����ͼ��ʾ��
C6H5CH=H2(g)+CO(g) +H2O(g) ��H �����ұ���ƽ��ת����Ӱ����ͼ��ʾ��

����H_____0�����������������=������ѹǿp1��p2��p3�Ӵ�С��˳����________��
��3��CO�ɱ�NO2������CO+NO2![]() CO2+NO�����¶ȸ���225��ʱ����Ӧ����v ��=k����c(CO)��c(NO2)��v��=k����c(CO2)��c(NO)��k����k���ֱ�Ϊ�����淴Ӧ���ʳ������������¶ȷ�Χ�ڣ�k����k����÷�Ӧ��ƽ�ⳣ��K֮��Ĺ�ϵΪ________��
CO2+NO�����¶ȸ���225��ʱ����Ӧ����v ��=k����c(CO)��c(NO2)��v��=k����c(CO2)��c(NO)��k����k���ֱ�Ϊ�����淴Ӧ���ʳ������������¶ȷ�Χ�ڣ�k����k����÷�Ӧ��ƽ�ⳣ��K֮��Ĺ�ϵΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��ijѧ����Ƶ�ʵ�����Ʊ�������Cl2�����ն���������ʵ��װ��ͼ����ش�
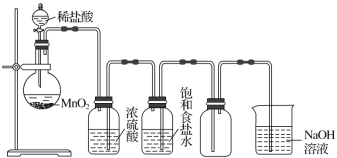
(1)ָ������ͼ�еĸ�������_______����_________����_________����_________��
(2)�ڸĽ����װ���У��������ʵ����÷ֱ��ǣ��ٱ���ʳ��ˮ________����Ũ����_________����NaOH��Һ_________��
(3)д�����з�Ӧ�Ļ�ѧ����ʽ����Բ����ƿ�н��е����ӷ���ʽ_____________��
��NaOH��Һ�з����Ļ�ѧ��Ӧ����ʽ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£������Ϊ3 L���ܱ������У�һ����̼��������Ӧ���ɼ״�(����ΪCu2O/ZnO)��CO(g)��2H2(g)![]() CH3OH(g)
CH3OH(g)

��������������и��⣺
��1����Ӧ�ﵽƽ��ʱ��ƽ�ⳣ������ʽK��______�������¶ȣ�Kֵ________(���������С�����䡱)��
��2����500 �棬�ӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v(H2)��_____��[����n(B)��t(B)��ʾ]��
��3���������������������£��Դ���E�����ϵ���ѹ����ԭ����1/2���������йظ���ϵ��˵����ȷ���� ________
a��������Ũ�ȼ�С b������Ӧ���ʼӿ죬�淴Ӧ����Ҳ�ӿ�
c���״������ʵ������� d������ƽ��ʱn(H2)/n(CH3OH)����
��4�����о�����Ӧ������������õ�ΪCu2O��CO����ʹ�����ж���ʧЧ������Ӧ��ϵ�к�����CO2������ά�ִ���Cu2O�������䣬ԭ���ǣ�_________(�û�ѧ����ʽ��ʾ)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com