
【题目】以石墨负极(C)、LiFePO4正极组成的锂离子电池的工作原理如图所示(实际上正负极材料是紧贴在锂离子导体膜两边的)。充放电时,Li+在正极材料上脱嵌或嵌入,随之在石墨中发生了LixC6生成与解离。下列说法正确的是
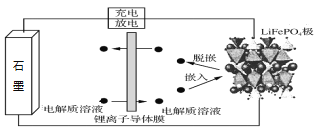
A. 锂离子导电膜应有保护成品电池安全性的作用
B. 该电池工作过程中Fe元素化合价没有发生变化
C. 放电时,负极材料上的反应为6C+xLi++ xe- =LixC6
D. 放电时,正极材料上的反应为LiFePO4 - xe- = Li1-xFePO4 + xLi+
【答案】A
【解析】
根据题意描述,放电时,石墨为负极,充电时,石墨为阴极,石墨转化LixC6,得到电子,石墨电极发生还原反应,与题意吻合,据此分析解答。
根据上述分析,总反应为LiFePO4+6C ![]() Li1-xFePO4+LixC6。
Li1-xFePO4+LixC6。
A. 为了防止正负极直接相互接触,因此用锂离子导电膜隔开,锂离子导体膜起到保护成品电池安全性的作用,故A正确;
B. 根据总反应方程式LiFePO4+6C ![]() Li1-xFePO4+LixC6可知,LiFePO4与Li1-xFePO4中铁元素的化合价一定发生变化,否则不能构成原电池反应,故B错误;
Li1-xFePO4+LixC6可知,LiFePO4与Li1-xFePO4中铁元素的化合价一定发生变化,否则不能构成原电池反应,故B错误;
C. 放电时,负极发生氧化反应,电极反应式为:LixC6- xe- =6C+xLi+,故C错误;
D. 放电时,Li1-xFePO4在正极上得电子发生还原反应,电极反应为:Li1-xFePO4+xLi++xe-═LiFePO4,故D错误;
答案选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】近年,一些药物引起的不良反应引起了人们的关注。因此在开发新药时如何减少毒副作用是一个很重要的课题。在下列结构简式中,Ⅰ是扑热息痛,Ⅱ是阿司匹林,它们都是临床应用广泛的解热镇痛药,但Ⅰ易导致肾脏中毒,Ⅱ对胃黏膜有刺激性,多用会引起胃溃疡。Ⅲ是扑炎痛,它是根据药物合成中“拼合原理”的方法,设计并合成出的解热镇痛药。这三种物质的结构简式如下:

试回答:
(1)为什么阿司匹林会有上述的毒副作用?___________
(2)合成扑炎痛的反应属于有机化学中的哪一类反应?_________
(3)扑炎痛本身并无解热镇痛的功效,但口服进入人体内后会产生上述药理作用,且毒副作用没有Ⅰ和Ⅱ那么明显,试加以解_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知砒霜(As2O3)与锌可以发生如下反应:As2O3+6Zn+6H2SO4=2AsH3+6ZnSO4+3H2O。
(1)请用“双线桥法”标出电子转移的方向和数目:____________。
(2)砒霜在上述反应中显示出来的性质是_______(填字母)。
A.氧化性 B.还原性 C.酸性 D.碱性
(3)该反应的氧化产物是___,还原产物是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
氮的化合物在生产、生活中有广泛应用。
(1)氮化镓(GaN)是新型的半导体材料。基态氮原子的核外电子排布图为____;基态镓(Ga)原子的核外具有____种不同能量的电子。
(2)乙二氨的结构简式为(H2N-CH2-CH2-NH2,简写为en)。
①分子中氮原子轨道杂化类型为____;
②乙二氨可与铜离子形成配合离子[Cu(en)2]2+,其中提供孤电子对的原子是____,配合离子结构简式为____;
③乙二氨易溶于水的主要原因是____。
(3)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。

①图1中氮原子的配位数为____,离硼原子最近且等距离的硼原子有____个;
②已知六方氮化硼同层中B与N之间的距离为acm,密度为dgcm-3,则相邻层与层之间的距离为____pm(列出表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2SO2+O2![]() 2SO3的叙述不正确的是( )
2SO3的叙述不正确的是( )
A.该反应是可逆反应
B.反应方程式中“![]() ”表示在相同条件下,反应可以同时向两个方向进行
”表示在相同条件下,反应可以同时向两个方向进行
C.1 mol O2与2 mol SO2混合反应,可生成2 mol SO3
D.在该反应中SO2作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)![]() 2SO3(g);正反应放热。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是:
2SO3(g);正反应放热。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是:

A. 图I研究的是t0时刻增大O2的浓度对反应速率的影响
B. 图II研究的是t0时刻加入催化剂后对反应速率的影响
C. 图III研究的是催化剂对平衡的影响,且甲的催化效率比乙高
D. 图III研究的是温度对化学平衡的影响,且甲的温度较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.10 mol/L CuCl2溶液中滴加0.10mol/L Na2S溶液,滴加过程中-lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示。下列说法正确的是

A. Ksp(CuS)的数量级为10-21
B. 曲线上a点溶液中,c(S2-)c(Cu2+) > Ksp(CuS)
C. a、b、c三点溶液中,n(H+)和n(OH-)的积最小的为b点
D. c点溶液中:c(Na+)>c(Cl-)>c(S2-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)![]() 2NO(g) ΔH>0。已知该反应在2 404 ℃时,平衡常数K=64×10-4。请回答:
2NO(g) ΔH>0。已知该反应在2 404 ℃时,平衡常数K=64×10-4。请回答:
(1)某温度下,向2 L的密闭容器中充入N2和O2各1 mol,5分钟后O2的物质的量为0.5 mol,则N2的反应速率为___。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志___(填字母序号)。
A.消耗1 mol N2同时生成1 mol O2
B.混合气体密度不变
C.混合气体平均相对分子质量不变
D.2v正(N2)=v逆(NO)
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是__(填字母序号)。

(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气体中NO的体积分数_____(填“变大”“变小”或“不变”)。
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1 mol·L-1、4.0×10-2 mol·L-1和3.0×10-3 mol·L-1,此时反应________________(填“处于化学平衡状态”“向正反应方向进行”或“向逆反应方向进行”),理由是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲苯是有机合成的重要原料,既可用来合成抗流感病毒活性药物的中间体E,也可用来合成γ-分泌调节剂的药物中间体K,合成路线如下:

已知:ⅰ.R1NH2+Br-R2![]() R1-NH-R2+HBr
R1-NH-R2+HBr
ⅱ.![]()
(1)A的结构简式为______________。
(2)C中含氧官能团名称为_____________。
(3)C→D的化学方程式为_____________。
(4)F→G的反应条件为________________。
(5)H→I的化学方程式为________________。
(6)J的结构简式为_____________。
(7)利用题目所给信息,以![]() 和
和 为原料合成化合物L的流程如下,写出中间产物1和中间产物2的结构简式:______,_________。
为原料合成化合物L的流程如下,写出中间产物1和中间产物2的结构简式:______,_________。
①
②合成L的过程中还可能得到一种高分子化合物,其结构简式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com