
【题目】25℃将浓度均为0.1 mol/L的HA溶液和BOH溶液按体积分别为Va和Vb混合,保持Va+Vb=100 mL,且生成的BA可溶于水。已知Va、Vb与混合液pH关系如图。下列说法错误的是

A. 曲线II表示HA溶液体积
B. x点存在c(A-)+c(OH-)=c(B+)+c(H+)
C. 电离平衡常数K(HA)>K(BOH)
D. 向z点溶液加入NaOH,水的电离程度减小
【答案】C
【解析】
A. 由图可知,当HA溶液与BOH溶液等体积混合时,溶液的pH>7,随着曲线I体积的增大,溶液的pH逐渐增大,说明曲线I表示BOH溶液的体积,则曲线II表示HA溶液体积,故A正确;
B. 根据图像,x点HA溶液体积大于BOH溶液等体积,溶液为HA和BA的混合溶液,根据电荷守恒,有c(A-)+c(OH-)=c(B+)+c(H+),故B正确;
C. 由图可知,当HA溶液与BOH溶液等体积混合时,溶液的pH>7,溶液显碱性,说明K(HA)<K(BOH),故C错误;
D. 根据图像,z点HA溶液体积小于BOH溶液等体积,溶液为BA和BOH的混合溶液,碱过量水的电离程受抑制,所以向z点溶液加入NaOH,水的电离程度减小,故D正确。
故选C。


科目:高中化学 来源: 题型:
【题目】2001年是伟大的化学家、1954年诺贝尔化学奖得主、著名的化学结构大师、20世纪的科学怪杰鲍林(L.Pauling)教授的诞辰100周年。1994年这位老人谢世后,人们打开他的办公室,发现里面有一块黑板,画得满满的,其中一个结构式如图所示。老人为什么画这个结构式?它能合成吗?它有什么性质?不得而知。这是鲍林留给世人的一个谜,也许这是永远无法解开的谜,也许有朝一日你就能解开它。不管结果如何,让我们先对这个结构作一番了解。

(1)它的分子式是__________________________________________________________。
(2)它的所有原子是否可能处于同一个平面上?________(填“可能”或“不可能”)。
(3)它是否带有电荷?________(填“是”或“否”)。
(4)该分子中sp杂化的氮原子有___个;sp2杂化的氮原子有___个;sp3杂化的氮原子有_____个。
(5)为什么人们推测它是炸药?______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 以下是日常生活中常见的一些物质:①液氯、②酒精、③CO2、④熟石灰、⑤碳酸钠、⑥稀盐酸、⑦CaO、⑧Na2O2、⑨Cu,请你指出(填写序号):
(1)属于碱性氧化物的是______;能导电的是________。
(2)⑤在水中的电离方程式为____________。
(3)根据以上物质写出一个酸性氧化物与碱溶液反应的离子方程式: __________。
II. 化学计量在化学中占有重要地位.根据计算填空:
(1)1.204×1022个HCl分子的物质的量为______,该气体溶于水配制成500 mL的溶液,则溶液中Cl﹣的物质的量浓度为______。
(2)标准状况下体积为44.8LSO2与______g H2所含的分子数相同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着我国汽车年销量的大幅增加,给空气环境造成了很大的污染。汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )

A. 反应中NO为氧化剂,N2为氧化产物
B. 汽车尾气的主要污染成分包括CO、NO和N2
C. NO和O2必须在催化剂表面才能反应
D. 催化转化总化学方程式为2NO+O2+4CO ![]() 4CO2+N2
4CO2+N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1 L容器中用O2将HCl转化为Cl2,反应方程式为:4HCl(g)+O2(g)![]() 2H2O(g)+2Cl2(g) ΔH<0,一定条件下测得反应过程中n(Cl2)的实验数据如下。下列说法正确的是( )
2H2O(g)+2Cl2(g) ΔH<0,一定条件下测得反应过程中n(Cl2)的实验数据如下。下列说法正确的是( )
t/min | 0 | 2 | 4 | 6 |
n(Cl2)/10-3 mol | 0 | 1.8 | 3.7 | 5.4 |
A. 0~2 min的反应速率小于4~6 min的反应速率
B. 2~6 min用Cl2表示的反应速率为0.9 mol/(L·min)
C. 增大压强可以提高HCl转化率
D. 平衡常数K(200 ℃)<K(400 ℃)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe3O4中含有![]() 、
、![]() ,分别表示为Fe(Ⅱ)、Fe(Ⅲ),以Fe3O4/Pd为催化材料,可实现用H2消除酸性废水中的致癌物NO2-,其反应过程示意图如图所示,下列说法不正确的是
,分别表示为Fe(Ⅱ)、Fe(Ⅲ),以Fe3O4/Pd为催化材料,可实现用H2消除酸性废水中的致癌物NO2-,其反应过程示意图如图所示,下列说法不正确的是

A. Pd上发生的电极反应为:H2 - 2e- 2H+
B. Fe(Ⅱ)与Fe(Ⅲ)的相互转化起到了传递电子的作用
C. 反应过程中NO2-被Fe(Ⅱ)还原为N2
D. 用该法处理后水体的pH降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某高能锂离子电池的总反应为:2Li+FeS= Fe +Li2S,电解液为含LiPF6.SO(CH3)2的有机溶液(Li+可自由通过)。某小组以该电池为电源电解废水并获得单质镍,工作原理如图所示。

下列分析正确的是
A. 该锂离子电池正极反应为FeS+2Li++2e-=Fe +Li2S
B. X与电池的Li电极相连
C. 电解过程中c(BaC12)保持不变
D. 若去掉阳离子膜将左右两室合并,则X电极的反应不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠常用作漂白剂。某化学小组设计实验制备亚氯酸钠,并进行杂质分析。
实验I 按图装置制备NaC1O2晶体

已知:①C1O2为黄绿色气体,极易与水反应。
②NaC1O2饱和溶液在低于38℃时析出NaC1O2·3H2O晶体,高于38℃时析出NaC1O2晶体,温度高于60℃时NaC1O2分解生成NaC1O3和NaCl。
(1)装置A中b仪器的名称是____;a中能否用稀硫酸代替浓硫酸____(填“能”或“不能”),原因是____。
(2)A中生成C1O2的化学反应方程式为____。
(3)C中生成NaC1O2时H2O2的作用是____;为获得更多的NaC1O2,需在C处添加装置进行改进,措施为____。
(4)反应后,经下列步骤可从C装置的溶液中获得NaC1O2晶体,请补充完善。
i.55℃时蒸发结晶 ii.__________ ii.用40℃热水洗涤 iv.低于60℃干燥,得到成品
实验Ⅱ 样品杂质分析
(5)上述实验中制得的NaC1O2晶体中还可能含有少量中学常见的含硫钠盐,其化学式为____,实验中可减少该杂质产生的操作(或方法)是____(写一条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是某学生设计的实验室制备并干燥Cl2及吸收多余氯气的实验装置图,请回答:
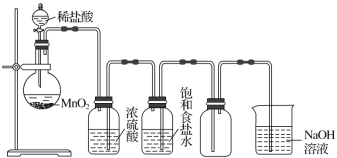
(1)指出上述图中的各处错误:①_______;②_________;③_________;④_________。
(2)在改进后的装置中,下列物质的作用分别是:①饱和食盐水________;②浓硫酸_________;③NaOH溶液_________。
(3)写出下列反应的化学方程式。①圆底烧瓶中进行的离子方程式_____________;
②NaOH溶液中发生的化学反应方程式____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com