
【题目】某温度下,向10 mL 0.1 mol/L CuCl2溶液中滴加0.1mol/L的Na2S溶液,滴加过程中-lg c(Cu2+)与Na2S溶液体积的关系如图所示.下列有关说法正确的是( )

A.0.1mol/LNa2S溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S)
B.a、b、c三点对应的溶液中,水的电离程度最大的为b点
C.该温度下,Ksp(CuS)的数量级为10-36
D.向10 mL Ag+、Cu2+物质的量浓度均为0.1mol/L的混合溶液中逐滴加入0.01mol/L的Na2S溶液,Cu2+先沉淀[已知:Ksp(Ag2S)=6.4×10-50]
【答案】C
【解析】
A.依据质子守恒,c(OH-)=c(H+)+c(HS-)+2c(H2S),A错误;
B.a、c两点Cu2+、S2-的水解促进了水的电离,水的电离程度增大,b点可认为是NaCl溶液,水的电离没有被促进,水的电离程度最小,B错误;
C.Ksp(CuS)等于10-17.7的平方(10-35.4),数量级为10-36,C正确;
D.刚开始产生Ag2S沉淀时,c2(Ag+) c(S2-)= Ksp(Ag2S),其中c(Ag+)= 0.1mol/L,则此时c(S2-)=6.4×10-48mol/L,同理,刚产生刚开始产生CuS沉淀时,c(Cu2+)c(S2-)= Ksp(CuS),其中c(Cu2+)= 0.1mol/L,则此时c(S2-)=10-34.4mol/L,故Ag+先沉淀,D错误。
故选C。


科目:高中化学 来源: 题型:
【题目】(1)写出石英主要成分的化学式:_____________;写出异丁烷的结构简式:_____________
(2)联氨(又称为肼,分子式为N2H4)一种高能燃料,常备用于火箭、航天领域,通常用过量NH3与NaClO反应制得。
①请写出NH3的电子式:________________________
②肼溶于水显弱碱性,其原理与氨相似。请用电离方程式解释肼的水溶液显碱性的原因是:________
③请写出上述制备肼的化学方程式:______________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】八十年代,我国化学家打破了西方国家对维生素C的垄断,发明的“两段发酵法”大大降低了生产成本。某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式如下:
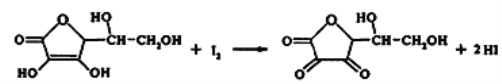
下列说法正确的是
A. 上述反应为取代反应
B. 维生素C水解得到2种产物
C. 维生素C有酯基不能溶于水,可溶于有机溶剂
D. 该反应表明维生素C具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X、Y、Z在周期表中的相对位置如图所示。已知Y元素原子的外围电子排布为ns(n-1)np(n+1),则下列说法不正确的是( )
![]()
A. Y元素原子的外围电子排布为4s24p4
B. Y元素在周期表的第三周期ⅥA族
C. X元素所在周期中所含非金属元素最多
D. Z元素原子的核外电子排布式为1s22s22p63s23p63d104s24p3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。回答下列问题:
①NiO、FeO的晶体结构类型均与NaCl的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点:FeO____(填“<”或“>”)NiO。
②铁有δ、γ、α三种同素异形体,各晶胞结构如图所示,则δ、α两种晶胞中铁原子的配位数之比为____。
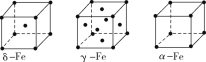
(2)元素金(Au)处于周期表中的第六周期,与Cu同族,一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数目之比为__;该晶体中,原子之间的相互作用是____。
(3)某钙钛型复合氧化物如图所示,以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe等时,这种化合物具有CMR效应。
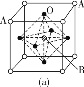
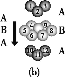
①用A、B、O表示这类特殊晶体的化学式:____。
②已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3(x<0.1),此时一部分锰转变为+4价,导致材料在某一温度附近有反铁磁—铁磁、铁磁—顺磁及金属—半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为____。
③下列有关说法正确的是____。
A.镧、锰、氧分别位于周期表f、d、p区
B.氧元素的第一电离能比氮元素的第一电离能大
C.锰的电负性为1.59,铬的电负性为1.66,说明锰的金属性比铬强
D.铬的堆积方式与钾相同,则其堆积方式如图(b)所示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式不正确的是
A.NaHCO3在水中的电离方程式:NaHCO3 = Na++HCO![]()
B.氯化镁溶液与氨水反应的离子方程式:Mg2++2OH-= Mg(OH)2↓
C.Cl2与水反应的离子方程式:Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
D.醋酸钠水解的离子方程式CH3COO-+H2O![]() CH3COOH+OH-
CH3COOH+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.100g质量分数为17%的H2O2水溶液中含氧原子数目为NA
B.0.1molH2(g)与0.1molI2(g)于密闭容器中充分反应生成HI(g)后,其分子总数小于0.2NA
C.8.0gCH4与足量Cl2在光照下反应生成的HCl分子数最多为2NA
D.标准状况下,将54g铝片投入足量冷的浓硝酸中生成134.4LNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列对于Na2SO3与NaHSO3的混合溶液中微粒浓度关系的说法正确的是()
A.一定存在3c(Na+)=c(HSO3)+c(SO32)+c(H2SO3)
B.一定存在c(Na+)+c(H+)=c(HSO3)+c(SO32)+c(OH-)
C.若混合溶液中n(Na2SO3)=2n(NaHSO3)时,溶液呈碱性,则有c(Na+)>c(SO32)>c(HSO3)>c(OH)>c(H+)
D.若混合溶液中n(Na2SO3)=n(NaHSO3)时,溶液呈酸性,则有c(Na+)>c(HSO3)>c(H+)>c(SO32)>c(OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符合的是
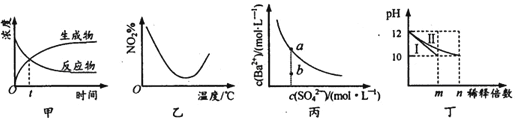
A. 图甲表示某可逆反应中物质浓度随时间的变化,反应在t时刻达到平衡状态
B. 图乙表示NO2在恒容密闭容器中发生反应:2NO2(g)![]() N2O4(g),NO2体积分数与温度的变化曲线,则该反应的正反应△H<O
N2O4(g),NO2体积分数与温度的变化曲线,则该反应的正反应△H<O
C. 图丙表示某温度时,BaSO4在水中的溶解平衡曲线,蒸发水可使溶液由b点变到a点
D. 图丁表示分别稀释l0mLpH均为12的NaOH和NH3·H2O溶液时pH的变化,曲线I表示NH3 H2O溶液,n>100
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com