
【题目】聚碳酸酯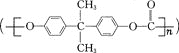 是一种高透明性的热塑性树脂,广泛用于汽车工业、仪器仪表、电器照明灯领域。它可用绿色化学原料X
是一种高透明性的热塑性树脂,广泛用于汽车工业、仪器仪表、电器照明灯领域。它可用绿色化学原料X![]() 与另一原料Y反应制得。下列说法不正确的是( )
与另一原料Y反应制得。下列说法不正确的是( )
A.该制备反应为缩聚反应
B.Y的分子式为C15H16O2
C.传统的合成方法原料X一般选用![]() ,则合成产物中必有大量HCl气体产生
,则合成产物中必有大量HCl气体产生
D.若将原料X选为CO2,在催化剂作用下实现理论原子利用率100%
科目:高中化学 来源: 题型:
【题目】下列关于有机物(a)![]() 的说法错误的是
的说法错误的是
A.a、b、c的分子式均为C8H8
B.b的所有原子可能处于同一平面
C.c的二氯代物有4种
D.a、b、c均能使溴水和酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠与二氧化氮能发生反应,某兴趣小组对此进行探究,提出了两种假设。
假设一:Na2O2+2NO2===2NaNO2+O2↑
假设二:Na2O2+2NO2===2NaNO3
[查阅资料]
2NaNO2+2HCl===2NaCl+NO↑+NO2↑+H2O
2NO2+2NaOH===NaNO2+NaNO3+H2O
[实验探究]
Ⅰ.按图示装置进行实验。
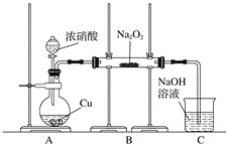
Ⅱ.通入二氧化氮至过氧化钠反应完全,然后对玻璃管中的固体物质进行检验。
[实验结论] 实验表明,过氧化钠与二氧化氮按“假设二”反应。
(1)过氧化钠与二氧化氮的反应中,氧化剂是____。
(2)装置A中反应的离子方程式是________。
(3)装置C的作用是__________。
(4)请设计实验证明装置B中的反应不符合“假设一”。
①实验操作:取玻璃管中的固体置于试管中,________;
②实验现象是________。
(5)有同学认为:只要直接观察C中导管口是否有气泡冒出,就可以判断B中的反应符合哪一种假设,这种想法________(填“对”或“不对”),原因是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林是日常生活中应用广泛的医药之一。它可由两步反应生成。
①邻羟基苯甲醛在一定条件下生成邻羟基苯甲酸;
②邻羟基苯甲酸与 CH3COCl 反应生成阿司匹林。
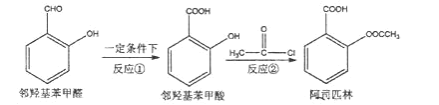
下列说法正确的是( )
A.反应①可使用酸性 KMnO4 溶液作氧化剂
B.反应②的另一产物是 HCl
C.1mol 阿司匹林最多可以和 2molNaOH 反应
D.邻羟基苯甲醛分子中在同一平面上的原子最多为 12 个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组学生用![]() 稀盐酸与
稀盐酸与![]() 的NaOH溶液在如图装置中进行中和反应.通过测定反应过程中所放出的热量计算反应热
的NaOH溶液在如图装置中进行中和反应.通过测定反应过程中所放出的热量计算反应热

![]() 装置中还缺少的主要仪器是 ______
装置中还缺少的主要仪器是 ______
![]() 若测得中和热值为
若测得中和热值为![]() ,写出表示稀盐酸和NaOH溶液反应中和热的热化学方程式 ______
,写出表示稀盐酸和NaOH溶液反应中和热的热化学方程式 ______
![]() 关于该实验,下列说法正确的是 ______
关于该实验,下列说法正确的是 ______
A.如图条件下实验过程中没有热量损失![]() 溶液浓度稍大的目的是使盐酸反应完全
溶液浓度稍大的目的是使盐酸反应完全
C.烧杯间填满碎纸条的作用是固定小烧杯![]() 溶液要分多次缓慢加入
溶液要分多次缓慢加入
![]() 若用相同体积相同浓度的醋酸代替盐酸,中和热的测定结果会 ______
若用相同体积相同浓度的醋酸代替盐酸,中和热的测定结果会 ______ ![]() “偏大”、“偏小”或“无影响”
“偏大”、“偏小”或“无影响”![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室在50~60℃下制备硝基苯的反应装置如图所示。下列有关说法错误的是( )

A.长玻璃导管的作用是冷凝回流、平衡压强
B.加入试剂的顺序:先加浓硝酸,再加浓硫酸,冷却后加入苯
C.将反应后的液体倒入烧杯中,加水
D.为了除去在硝基苯中的酸性物质,需要水洗、碱洗,然后再水洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率和限度与生产、生活密切相关。
(1)某同学为了探究锌与硫酸反应过程中的速率变化,在 400mL 稀硫酸中加入足量的锌粉,标况下用排水集气法收集反应放出的氢气,实验记录如下(累计值):
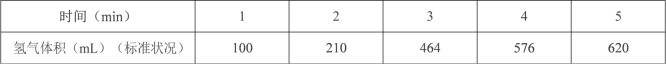
①哪一时间段反应速率最大_______min(填“0~1”、“1~2”、“2~3”、“3~4”、“4~5”), 原因是________。
②求 3~4 分钟时间段以盐酸的浓度变化来表示的该反应速率________设溶液体积不变)。
(2)该同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回 答下列问题:
①硫酸铜溶液可以加快氢气生成速率的原因是_______。
②实验室中现有 Na2SO4、MgSO4、Ag2SO4、K2SO4 等 4 种溶液,可与实验中 CuSO4 溶液起相似作用的是_______。
③要减慢上述实验中气体产生速率,可采取的合力措施有_______、_______(答两种)。
(3) 某温度下在 4 L 密闭容器中,X、Y、Z 三种气态物质的物质的量随时间变化曲线如图。
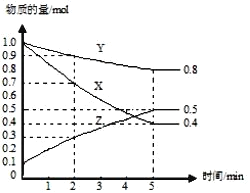
①该反应的化学方程式是_______。
②该反应达到平衡状态的标志是_______(填字母)
A.Y 的体积分数在混合气体中保持不变 B.X、Y 的反应速率比为 3:1
C.容器内气体压强保持不变 D.容器内气体的总质量保持不变E.生成 1 mol Y 的同时消耗 2 mol Z
③2 min 内 Y 的转化率为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学反应方程式为
H2(g)+![]() O2(g)=H2O(l) △H1
O2(g)=H2O(l) △H1
C(s)+O2(g)=CO2(g) △H2
CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H3
2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H4
则△H4的正确表达式为
A. △H3-2△H1-2△H2B. 2△H1+2△H2-△H3
C. 2△H1-2△H2+△H3D. 2△H1-2△H2-△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素的电负性和元素的化合价一样,也是元素的一种基本性质。下面给出14种元素的电负性。
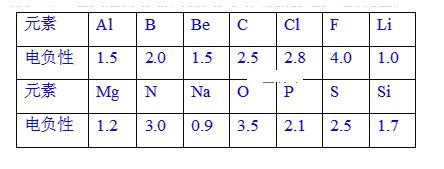
(1)根据表中给出的数据,可推知元素的电负性具有的变化规律是____。
(2)第3周期基态原子有2个未成对电子且电负性最大的元素是____(用元素符号表示)。
(3)下列化合物中属于共价化合物的是____。(Mg3N2、BeCl2、AlCl3、SiC)
(4)根据元素的电负性判断NCl3分子中Cl的化合价为____,已知水解反应前后各元素的化合价不变,则NCl3分子水解的化学方程式为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com