
【题目】下列关于有机物(a)![]() 的说法错误的是
的说法错误的是
A.a、b、c的分子式均为C8H8
B.b的所有原子可能处于同一平面
C.c的二氯代物有4种
D.a、b、c均能使溴水和酸性KMnO4溶液褪色
科目:高中化学 来源: 题型:
【题目】通常将一定量的有机物充分燃烧转化为简单的无机物,然后根据产物的质量确定有机物的组成。如图所示是用燃烧法确定有机物分子式的常用装置。
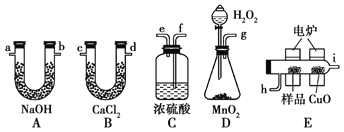
请回答下列问题:
(1)使产生的O2按从左到右的方向流动,则所选装置中各导管的正确连接顺序是________(填字母)。
(2)装置C中浓硫酸的作用是_____________________________________。
(3)燃烧管中CuO的作用是________________________________。
(4)若准确称取0.69 g样品(只含C、H、O三种元素中的两种或三种),充分燃烧后,A管质量增加1.32 g,B管质量增加0.81 g,则该有机物的实验式为________。
(5)要确定该有机物的分子式,还要知道该有机物的____,经测定其蒸气密度为 2.054 g/L(已换算为标准状况),则其分子式为______。
(6)该物质的核磁共振氢谱如图所示,则其结构简式为____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知溶液中,还原性HSO3>I-,氧化性IO3->I2。在含有3molNaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系如图所示,则下列说法中错误的是
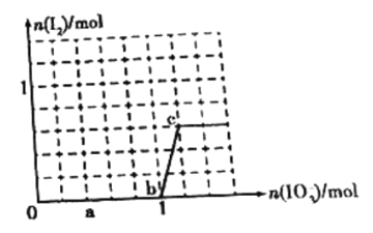
A. a点时NaHSO3剩余
B. b点时还原产物为I-
C. b点到c点,KIO3与NaHSO3反应生成I2
D. 加入的KIO3为0.4mol或1.12mol时,反应后溶液中I-均为0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,a、b、c…为部分元素。回答下列问题:
a | |||||||||||||||||
b | c | d | e | ||||||||||||||
f | g | ||||||||||||||||
h | |||||||||||||||||
(1)请画出上述元素h的原子结构示意图_______;元素h位于元素周期表的第_____区。
(2)e、g两种元素的气态氢化物中更稳定的是_______(写化学式);
(3)b2a2分子的电子式是________ ,该分子中存在的σ键与π键的个数比为_______。
(4)c、d两种元素中第一电离能较大的是_________(写元素符号)。
(5)f和g两种元素形成的化合物是______(填“离子化合物”“共价化合物”)。a2d分子是_________分子(填极性分子或者非极性分子)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯在多种条件下发生水解反应:CH3COOC2H5 + H2OCH3COOH+C2H5OH。已知该反应的速率随c(H+)的增大而加快。下图为CH3COOC2H5的水解速率随时间的变化图。下列说法错误的是( )
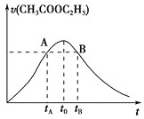
A.反应初期水解速率增大可能是溶液中c(H+)逐渐增大所致
B.A、B两点表示的c(CH3COOC2H5)相等
C.图中t0时反应达到平衡状态
D.CH3COOC2H5的转化率tA时低于tB时
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关短周期主族元素A、B、C、D、E、F的信息如下:
有关信息 | |
A | 其中一种核素的中子数为0 |
B | 最高价氧化物对应的水化物按1:1完全电离出电子数相等的阴、阳离子 |
C | 在地壳中的含量为第三位 |
D | 其单质在O2中燃烧,发出明亮的蓝紫色火焰 |
E | 是形成化合物种类最多的元素 |
F | 其单质常用做保护气体 |
(1)C元素是________(填元素名称),D在元素周期表中的位置是________。
(2)工业上得到C的单质常采用惰性电极电解熔融______(填化学式)的方法,C的单质可以和B的最高价氧化物的水化物发生反应,写出该反应的离子方程式:______。C形成某种化合物LiCA4既是金属储氢材料又是有机合成中的常用试剂,遇水能释放出A2,那么LiCA4中A元素的化合价为_________。
(3)在一定条件下,A与F可形成一种易溶于水的液体F2A4,其电子式为________;该物质可由NaClO与FA3反应制得,写出反应的化学方程式:_______,每生成1mol F2A4转移电子数为________。
(4)写出一个能证明E和F非金属性强弱的化学方程式________。
(5)化合物W由A、D、E、F四种元素组成。向W溶液中滴入FeCl3溶液,溶液变血红色;另取一份W溶液加入强碱溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体,W的化学式为________。
(6)F的简单氢化物的沸点比它的同族相邻周期元素氢化物沸点高,理由是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL![]() 的HR溶液中逐滴滴入
的HR溶液中逐滴滴入![]() 的
的![]() 溶液,所得溶液pH及导电能力变化如图
溶液,所得溶液pH及导电能力变化如图![]() 下列分析不正确的是
下列分析不正确的是![]()
![]()
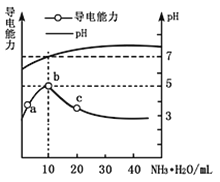
A. ![]() 点导电能力增强,说明HR为弱酸
点导电能力增强,说明HR为弱酸
B. b点溶液![]() ,此时酸碱恰好中和
,此时酸碱恰好中和
C. c点溶液存在![]() 、
、![]()
D. b、c两点水的电离程度:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下:(NA为阿伏加德罗常数的值),请用化学用语回答下列
元素 | 相关信息 |
A | 基态原子的价电子排布式为nsnnpn |
B | 元素原子的核外p电子数比s电子数少1个 |
C | 最外层电子数是电子层数的3倍 |
D | 简单离子是第三周期元素中离子半径最小的 |
E | 价电子层中的未成对电子数为4 |
(1)写出D元素在周期表的位置___,基态E2+价电子的排布图为___,B元素能量最高的电子其轨道呈__形。
(2)A与C形成的最高价化合物,中心原子轨道杂化类型为__。
(3)A、B、C三种基态原子的第一电离能由大到小的顺序为___,B、C、D简单离子的半径由大到小的顺序为___。
(4)写出C的核外有18个电子的氢化物的电子式___。
(5)E可用做某些反应的催化剂,CO易导致E失去催化活性:E+5CO=E(CO)5,E(CO)5熔点为-20℃,沸点为103℃,易溶于乙醚,其晶体类型为___。
(6)已知沸点:B2H4>A2H6,主要原因为________。
(7)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为___
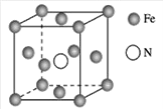
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com