
【题目】A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下:(NA为阿伏加德罗常数的值),请用化学用语回答下列
元素 | 相关信息 |
A | 基态原子的价电子排布式为nsnnpn |
B | 元素原子的核外p电子数比s电子数少1个 |
C | 最外层电子数是电子层数的3倍 |
D | 简单离子是第三周期元素中离子半径最小的 |
E | 价电子层中的未成对电子数为4 |
(1)写出D元素在周期表的位置___,基态E2+价电子的排布图为___,B元素能量最高的电子其轨道呈__形。
(2)A与C形成的最高价化合物,中心原子轨道杂化类型为__。
(3)A、B、C三种基态原子的第一电离能由大到小的顺序为___,B、C、D简单离子的半径由大到小的顺序为___。
(4)写出C的核外有18个电子的氢化物的电子式___。
(5)E可用做某些反应的催化剂,CO易导致E失去催化活性:E+5CO=E(CO)5,E(CO)5熔点为-20℃,沸点为103℃,易溶于乙醚,其晶体类型为___。
(6)已知沸点:B2H4>A2H6,主要原因为________。
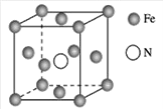
(7)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为___
【答案】第三周期第ⅢA族 ![]() 哑铃型 sp N>O>C r(N3)>r(O2)>r(Al3+)
哑铃型 sp N>O>C r(N3)>r(O2)>r(Al3+) ![]() 分子晶体 N2H4可形成分子间氢键,C2H6只有范德华力 Fe4N
分子晶体 N2H4可形成分子间氢键,C2H6只有范德华力 Fe4N
【解析】
A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,A的基态原子的价电子排布式为nsnnpn,n只能为2,则A为C元素;B元素原子的核外p电子数比s电子数少1个,B的质子数为7,电子排布式为1s22s22p3,则B为N元素;C的最外层电子数是电子层数的3倍,有2个电子层符合电子排布规律,最外层电子数为6,则C为O元素;D简单离子是第三周期元素中离子半径最小,则D为Al元素;E的价电子层中的未成对电子数为4,价电子排布式为3d64s2,则E为Fe元素。
(1)D为Al元素,在元素周期表中的位置为第三周期第ⅢA族,E为Fe元素,基态Fe2+价电子的排布图为:![]() ,B为N元素,N元素能量最高的电子为2p,其轨道呈哑铃型形,故答案为:第三周期第ⅢA族;
,B为N元素,N元素能量最高的电子为2p,其轨道呈哑铃型形,故答案为:第三周期第ⅢA族;![]() ;哑铃型。
;哑铃型。
(2)A为C元素,C为O元素,其形成的最高价化合物为二氧化碳,其结构式为O=C=O,为直线型,中心原子轨道杂化类型为sp杂化,故答案为:sp;
(3)A、B、C三种元素分别为:C、N、O,同周期,从左到右,第一电离能增大,N的2p轨道半充满,为稳定结构,则第一电离能由大到小的顺序为N>O>C,B、C、D分别为:N、O、Al,具有相同电子层结构的离子中原子序数大的离子半径小,则简单离子的半径由大到小的顺序为:r(N3)>r(O2)>r(Al3+),故答案为:N>O>C;r(N3)>r(O2)>r(Al3+)。
(4)C为O元素,核外有18个电子的氢化物是过氧化氢。其电子式为![]() ,故答案为:
,故答案为:![]() 。
。
(5)E为Fe元素,Fe(CO)5熔点为20℃,沸点为103℃,易溶于乙醚,熔沸点低,可知其晶体类型为分子晶体,故答案为:分子晶体。
(6)A为C元素,B为N元素,已知沸点:N2H4>C2H6,主要原因为N2H4可形成分子间氢键,C2H6只有范德华力,故答案为:N2H4可形成分子间氢键,C2H6只有范德华力;
(7)由晶胞结构图可知,N位于体心,个数为1,而Fe位于顶点和面心,个数为8×![]() +6×
+6×![]() =4,则氮化铁的化学式为Fe4N;故答案为:Fe4N。
=4,则氮化铁的化学式为Fe4N;故答案为:Fe4N。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列关于有机物(a)![]() 的说法错误的是
的说法错误的是
A.a、b、c的分子式均为C8H8
B.b的所有原子可能处于同一平面
C.c的二氯代物有4种
D.a、b、c均能使溴水和酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO的催化氧化在消除环境污染、净化空气等方面有重要价值。最新研究发现:常温下CO在Au/BN表面很难被O2氧化,但在H2O的参与下反应很容易发生,转化示意图如图:
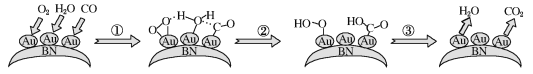
下列说法正确的是( )
A.CO2和H2O均只含极性共价键,且为极性分子
B.过程①有氢键形成
C.催化剂可以改变反应的路径,但不会改变反应速率和限度
D.在H2O和Au/BN的共同作用下,CO易被O2氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】断开1molH—H键、Cl—Cl键、H—Cl键需要吸收的能量分别为436kJ、243kJ、431kJ,则由Cl2和H2生成1molHCl时的反应热为
A. 吸热91.5kJB. 放热91.5kJ
C. 吸热183kJD. 放热183kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】举世闻名的侯氏制碱法的工艺流程如下图所示,下列说法正确的是( )

A.往母液中加入食盐的主要目的是使![]() 更多的析出
更多的析出
B.从母液中经过循环Ⅰ进入沉淀池的主要是![]() 、
、![]() 和氨水
和氨水
C.沉淀池中反应的化学方程式:![]()
D.设计循环Ⅱ的目的是使原料氯化钠的利用率大大提升
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20 ℃时向20 mL 0.1 mol·L-1醋酸溶液中不断滴入0.1 mol·L-1 NaOH溶液,溶液pH变化如图所示。此过程中溶液中离子浓度的关系错误的是( )
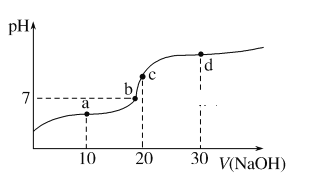
A. a点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B. b点:c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
C. c点:c(H+)=c(CH3COO-)+c(OH-)
D. d点:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的解释不正确的是
A.NaHS水溶液显碱性:HS-+H2OS2-+H3O+
B.苯酚能溶于Na2CO3溶液:C6H5OH+CO32-=C6H5O-+HCO3-
C.三元催化剂净化汽车尾气中的NO和CO:2NO+2CO![]() 2CO2+N2
2CO2+N2
D.铜矿淋溶液(CuSO4)遇方铅矿(PbS)发生沉积:Cu2++SO42-+PbS=CuS+PbSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)写出下列物质在水溶液中的电离方程式
NaHSO4___________
(NH4)2CO3_______________
NaHCO3_____________________
(2)现有以下物质:①NaCl溶液 ②干冰 ③ 液态HCl ④铜 ⑤BaSO4固体 ⑥ 蔗糖⑦Na2O ⑧NaOH固体 ⑨盐酸 ⑩NH3
其中能够导电的是__(填序号,下同);属于电解质的是_______;属于非电解质的是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤素单质在碱性溶液中容易发生歧化反应,歧化的产物依反应温度的不同而不同。
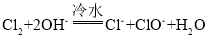 、
、![]()
下图为制取氯气、氯酸钾、次氯酸钠和检验氯气性质的微型实验装置:
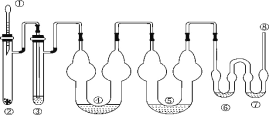
装置中盛装的药品如下:
①胶头滴管中装有 5 mL 浓盐酸;②微型具支试管中装有 1.5 g KMnO4;③微型具支试管中装有 2~3 mL 浓硫酸;④U 形反应管中装有 30% KOH 溶液;⑤U 形反应管中装有 2 mol·L-1 NaOH 溶液;⑥、⑦双 U 形反应管中分别装有 0.1 mol·L-1 KI-淀粉溶液和 KBr 溶液;⑧尾气出口用浸有 0.5 mol·L-1 Na2S2O3 溶液的棉花轻轻覆盖住
(1)检查整套装置气密性的方法是_________。
(2)为了使装置④⑤中的反应顺利完成,应该控制的反应条件分别为_______、_______。
(3)装置⑥⑦中能够观察到的实验现象分别是_________, _______。
(4)如果把装置⑥⑦中的试剂互换位置,则______(填“能”或“不能”)证明氧化性 Cl2>I2,理由是________。
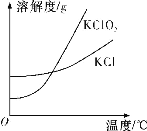
(5)已知氯酸钾和氯化钾的溶解度曲线如图所示,反应结束后,从装置④所得溶液中提取氯酸钾晶体的实验操作是________。
(6)尾气处理时 Cl2 发生反应的离子方程式为_________。
(7)选择微型实验装置的优点有____________(任答两点)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com