
【题目】20 ℃时向20 mL 0.1 mol·L-1醋酸溶液中不断滴入0.1 mol·L-1 NaOH溶液,溶液pH变化如图所示。此过程中溶液中离子浓度的关系错误的是( )
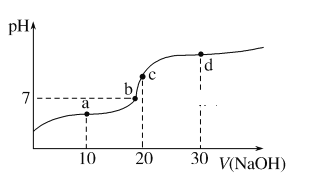
A. a点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B. b点:c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
C. c点:c(H+)=c(CH3COO-)+c(OH-)
D. d点:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
【答案】C
【解析】
A. a点滴入10 mL 0.1 mol·L-1 NaOH溶液,溶质是等浓度的醋酸钠和醋酸,溶液呈酸性,所以c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故A正确;
B. b点溶液呈中性,根据电荷守恒c(Na+)=c(CH3COO-)>c(H+)=c(OH-),故B正确;
C. c点表示等体积、等浓度的醋酸与氢氧化钠溶液混合,溶质是醋酸钠,根据电荷守恒c(H+)=c(CH3COO-)+c(OH-)- c(Na+),故C错误;
D. d点为醋酸钠、氢氧化钠的混合液,溶液呈碱性,根据电荷守c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故D正确;选C。


科目:高中化学 来源: 题型:
【题目】乙酸乙酯在多种条件下发生水解反应:CH3COOC2H5 + H2OCH3COOH+C2H5OH。已知该反应的速率随c(H+)的增大而加快。下图为CH3COOC2H5的水解速率随时间的变化图。下列说法错误的是( )
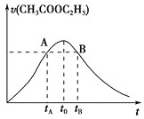
A.反应初期水解速率增大可能是溶液中c(H+)逐渐增大所致
B.A、B两点表示的c(CH3COOC2H5)相等
C.图中t0时反应达到平衡状态
D.CH3COOC2H5的转化率tA时低于tB时
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在钯基催化剂表面上,甲醇制氢的反应历程如图所示,其中吸附在钯催化剂表面上的物种用*标注。
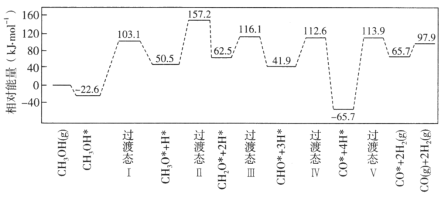
(1)![]() 的△H=_____________kJ·mol-1;该历程中最大能垒(活化能)E正=____________kJ·mol-1,写出该步骤的化学方程式_________________。
的△H=_____________kJ·mol-1;该历程中最大能垒(活化能)E正=____________kJ·mol-1,写出该步骤的化学方程式_________________。
(2)在一定温度下,CO和H2混合气体发生反应:![]() ,反应速率υ=υ正-υ逆=k正c(CO)·c2(H2)-k逆c(CH3OH),k正、k逆分别为正、逆反应速率常数。达到平衡后,若加入高效催化剂,
,反应速率υ=υ正-υ逆=k正c(CO)·c2(H2)-k逆c(CH3OH),k正、k逆分别为正、逆反应速率常数。达到平衡后,若加入高效催化剂,![]() 将___________(填“增大”、“减小”或“不变”);若升高温度,
将___________(填“增大”、“减小”或“不变”);若升高温度,![]() 将____________(填“增大”、“减小”或“不变”)。
将____________(填“增大”、“减小”或“不变”)。
(3)353K时,在刚性容器中充入CH3OH(g),发生反应:![]() 。体系的总压强p随时间t的变化如表所示:
。体系的总压强p随时间t的变化如表所示:
t/min | 0 | 5 | 10 | 15 | 20 | ∞ |
p/kPa | 101.2 | 107.4 | 112.6 | 116.4 | 118.6 | 121.2 |
①若升高反应温度至373K,则CH3OH(g)分解后体系压强p∞(373K)___________121.2kPa(填“大于”、“等于”或“小于”),原因是________________________。
②353K时,该反应的平衡常数KP=__________(kPa)2(KP为以分压表示的平衡常数,计算结果保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质N2、H2O、Na2O2、CaCl2、KOH、NaF中,既含有离了键,又含有共价键的物质是_____,属于共价化合物的是__________。
(2)用电子式表示CaCl2的形成过程:________________。
(3)氮化钠(Na3N)是科学家制备的一种重要化合物,它与水作用产生NH3。请写出NH3的电子式是____________。
(4)Na3N与盐酸反应生成两种盐,反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下:(NA为阿伏加德罗常数的值),请用化学用语回答下列
元素 | 相关信息 |
A | 基态原子的价电子排布式为nsnnpn |
B | 元素原子的核外p电子数比s电子数少1个 |
C | 最外层电子数是电子层数的3倍 |
D | 简单离子是第三周期元素中离子半径最小的 |
E | 价电子层中的未成对电子数为4 |
(1)写出D元素在周期表的位置___,基态E2+价电子的排布图为___,B元素能量最高的电子其轨道呈__形。
(2)A与C形成的最高价化合物,中心原子轨道杂化类型为__。
(3)A、B、C三种基态原子的第一电离能由大到小的顺序为___,B、C、D简单离子的半径由大到小的顺序为___。
(4)写出C的核外有18个电子的氢化物的电子式___。
(5)E可用做某些反应的催化剂,CO易导致E失去催化活性:E+5CO=E(CO)5,E(CO)5熔点为-20℃,沸点为103℃,易溶于乙醚,其晶体类型为___。
(6)已知沸点:B2H4>A2H6,主要原因为________。
(7)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为___
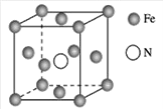
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中通入A、B、C三种气体,保持一定温度,在t1~t4s时测得各物质的浓度如表,则下列判断正确的是
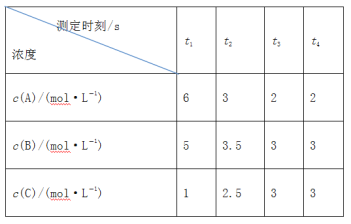
A.在t3s时反应已经停止
B.t3~t4s内正、逆反应速率不相等
C.在容器中发生的反应为A(g)+B(g)![]() C(g)
C(g)
D.在t2~t3s内A的平均反应速率为![]() mol·L1·s1
mol·L1·s1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
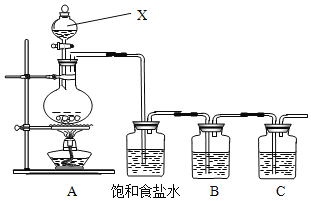
(1)请写出A装置中发生反应的化学方程式___。
(2)饱和食盐水的作用是_____。
(3)装置B中盛放的试剂是___(选填下列所给试剂的编号),反应离子方程式是__。
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)装置C中盛放的是烧碱溶液,目的是:______________________
(5)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强_____(填编号)
①HCl比H2S稳定 ②HClO氧化性比H2SO4强 ③HClO4酸性比H2SO4强 ④HCl酸性比H2S强 ⑤氯原子最外层有7个电子,硫原子最外层有6个电子 ⑥铁与Cl2反应生成FeCl3,而硫与铁反应生成FeS
(6)此装置有多种用途,若用此装置验证氯元素的非金属性比碘元素的强,需要在B装置中加入KI溶液,通入一段时间气体后向B中加入少量CCl4,振荡。能够证明氯元素的非金属性比碘元素的强的实验现象是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资料显示:FeF3溶液接近无色。某同学据此进行以下实验,依据上述实验无法获得的结论是
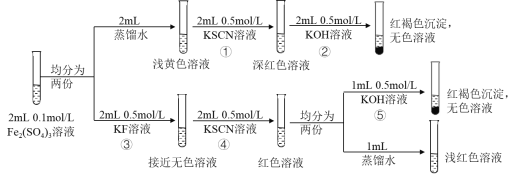
A.FeF3是弱电解质
B.④中发生的离子反应为FeF3+3SCN-Fe(SCN)3+3F-
C.相同条件下,结合Fe3+的能力:SCN->F->OH-
D.向Fe(SCN)3溶液中加入NaF固体,溶液颜色会变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列几组物质,请将序号填入下列空格内:
A C60和石墨 B 126C和136C C 冰醋酸和乙酸 D CH3CHO与![]() E 甲烷和十二烷 F 乙醇和乙二醇
E 甲烷和十二烷 F 乙醇和乙二醇
①互为同位素的是_________;
②互为同系物的是___________;
③互为同分异构体的是________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com