
【题目】常温下,向10mL![]() 的HR溶液中逐滴滴入
的HR溶液中逐滴滴入![]() 的
的![]() 溶液,所得溶液pH及导电能力变化如图
溶液,所得溶液pH及导电能力变化如图![]() 下列分析不正确的是
下列分析不正确的是![]()
![]()
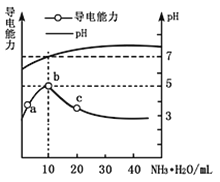
A. ![]() 点导电能力增强,说明HR为弱酸
点导电能力增强,说明HR为弱酸
B. b点溶液![]() ,此时酸碱恰好中和
,此时酸碱恰好中和
C. c点溶液存在![]() 、
、![]()
D. b、c两点水的电离程度:![]()
科目:高中化学 来源: 题型:
【题目】阳离子交换膜法电解饱和食盐水具有综合能耗低、环境污染小等优点。生产流程如下图所示:
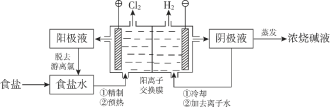
(1)电解饱和食盐水的化学方程式为________。
(2)电解结束后,能够脱去阳极液中游离氯的试剂或方法是________(填字母序号)。
a.Na2SO4b.Na2SO3
c.热空气吹出d.降低阳极区液面上方的气压
(3)食盐水中的I—若进入电解槽,可被电解产生的Cl2氧化为ICl,并进一步转化为IO3—。IO3—可继续被氧化为高碘酸根(IO4—),与Na+结合生成溶解度较小的NaIO4沉积于阳离子交换膜上,影响膜的寿命。
①从原子结构的角度解释ICl中碘元素的化合价为+1价的原因:________。
②NaIO3被氧化为NaIO4的化学方程式为________。
(4)在酸性条件下加入NaClO溶液,可将食盐水中的I-转化为I2,再进一步除去。通过测定体系的吸光度,可以检测不同pH下I2的生成量随时间的变化,如下图所示。已知:吸光度越高表明该体系中c(I2)越大。
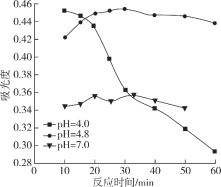
①结合化学用语解释10 min时不同pH体系吸光度不同的原因:________。
②pH=4.0时,体系的吸光度很快达到最大值,之后快速下降。吸光度快速下降的可能原因:________。
③研究表明食盐水中I-含量≤0.2 mgL-1时对离子交换膜影响可忽略。现将1m3含I-浓度为1.47 mgL-1 的食盐水进行处理,为达到使用标准,理论上至少需要0.05 molL-1 NaClO溶液________L。(已知NaClO的反应产物为NaCl,溶液体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物(a)![]() 的说法错误的是
的说法错误的是
A.a、b、c的分子式均为C8H8
B.b的所有原子可能处于同一平面
C.c的二氯代物有4种
D.a、b、c均能使溴水和酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组设计的糖厂甘蔗渣利用方案如下图所示:其中:A是植物生长调节剂,B是高分子化合物,D是具有水果香味的物质。请回答以下问题:
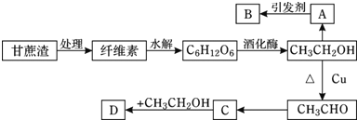
(1)纤维素的化学式为________,是________(填“纯净物”或“混合物”)。
(2)B的结构简式为________,C中官能团的名称为________。
(3)写出下列转化的化学方程式:CH3CH2OH→CH3CHO:_______,反应类型为________。
(4)化学式为C5H10O2的同分异构体中是C的同系物的有______种,其中在核磁共振氢谱上只有2个峰,且峰面积之比为1:9的结构简式为_______。
(5)下列说法正确的是________(填字母)。
A.生产A的主要方法是石油裂解,其产量是衡量一个国家石油化工水平的标志之一
B.分馏石油得到的各个馏分为纯净物
C.B可用于制造食品包装袋
D.塑料、合成纤维、合成橡胶等都是合成有机高分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质可溶于水、乙醇,熔点为209.5℃,其分子的结构简式如图,下列说法不正确的是( )
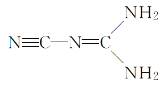
A.该分子与水分子可以形成氢键
B.该分子中原子最外层均达到8电子稳定结构的为C、N
C.1mol该物质中σ键和π键的个数比为5:3
D.该分子中C原子的杂化方式有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙均为1L的恒容密闭容器,向甲中充入1molCH4和1molCO2,乙中充入1molCH4和nmolCO2,在催化剂存在下发生反应:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g),测得CH4的平衡转化率随温度的变化如图所示。下列说法正确的是
2CO(g)+2H2(g),测得CH4的平衡转化率随温度的变化如图所示。下列说法正确的是
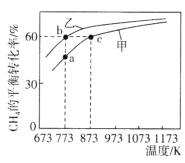
A.该反应的正反应是吸热反应
B.773K时,该反应的平衡常数小于12.96
C.H2的体积分数:![]()
D.873K时,向甲的平衡体系中再充入CO2、CH4各0.4mol,CO、H2各1.2mol,平衡不发生移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO的催化氧化在消除环境污染、净化空气等方面有重要价值。最新研究发现:常温下CO在Au/BN表面很难被O2氧化,但在H2O的参与下反应很容易发生,转化示意图如图:
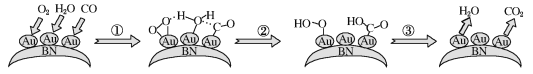
下列说法正确的是( )
A.CO2和H2O均只含极性共价键,且为极性分子
B.过程①有氢键形成
C.催化剂可以改变反应的路径,但不会改变反应速率和限度
D.在H2O和Au/BN的共同作用下,CO易被O2氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】断开1molH—H键、Cl—Cl键、H—Cl键需要吸收的能量分别为436kJ、243kJ、431kJ,则由Cl2和H2生成1molHCl时的反应热为
A. 吸热91.5kJB. 放热91.5kJ
C. 吸热183kJD. 放热183kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)写出下列物质在水溶液中的电离方程式
NaHSO4___________
(NH4)2CO3_______________
NaHCO3_____________________
(2)现有以下物质:①NaCl溶液 ②干冰 ③ 液态HCl ④铜 ⑤BaSO4固体 ⑥ 蔗糖⑦Na2O ⑧NaOH固体 ⑨盐酸 ⑩NH3
其中能够导电的是__(填序号,下同);属于电解质的是_______;属于非电解质的是_____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com