
【题目】阳离子交换膜法电解饱和食盐水具有综合能耗低、环境污染小等优点。生产流程如下图所示:
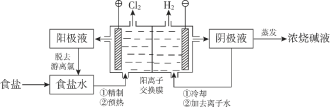
(1)电解饱和食盐水的化学方程式为________。
(2)电解结束后,能够脱去阳极液中游离氯的试剂或方法是________(填字母序号)。
a.Na2SO4b.Na2SO3
c.热空气吹出d.降低阳极区液面上方的气压
(3)食盐水中的I—若进入电解槽,可被电解产生的Cl2氧化为ICl,并进一步转化为IO3—。IO3—可继续被氧化为高碘酸根(IO4—),与Na+结合生成溶解度较小的NaIO4沉积于阳离子交换膜上,影响膜的寿命。
①从原子结构的角度解释ICl中碘元素的化合价为+1价的原因:________。
②NaIO3被氧化为NaIO4的化学方程式为________。
(4)在酸性条件下加入NaClO溶液,可将食盐水中的I-转化为I2,再进一步除去。通过测定体系的吸光度,可以检测不同pH下I2的生成量随时间的变化,如下图所示。已知:吸光度越高表明该体系中c(I2)越大。
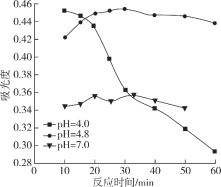
①结合化学用语解释10 min时不同pH体系吸光度不同的原因:________。
②pH=4.0时,体系的吸光度很快达到最大值,之后快速下降。吸光度快速下降的可能原因:________。
③研究表明食盐水中I-含量≤0.2 mgL-1时对离子交换膜影响可忽略。现将1m3含I-浓度为1.47 mgL-1 的食盐水进行处理,为达到使用标准,理论上至少需要0.05 molL-1 NaClO溶液________L。(已知NaClO的反应产物为NaCl,溶液体积变化忽略不计)
【答案】2 NaCl + 2H2O ![]() C12↑ + H2↑+ 2NaOH bcd 碘元素和氯元素处于同一主族(VIIA),二者最外层电子数均为7,ICl中共用一对电子,由于碘原子半径大于氯原子,碘原子得电子能力弱于氯原子,故共用电子对偏离碘原子,使得碘元素显+1价 Na++IO3—+ Cl2 + H2O=== NaIO4↓+ 2H++2Cl— ClO- + 2H+ + 2I-=== I2 + Cl- + H2O10 min时pH越低,c(H+)越大,反应速率加快(或ClO-氧化性增强),c(I2)越高,吸光度越大。 c(H+)较高,ClO-继续将I2 氧化为高价含碘微粒,c(I2)降低,吸光度下降 0.1
C12↑ + H2↑+ 2NaOH bcd 碘元素和氯元素处于同一主族(VIIA),二者最外层电子数均为7,ICl中共用一对电子,由于碘原子半径大于氯原子,碘原子得电子能力弱于氯原子,故共用电子对偏离碘原子,使得碘元素显+1价 Na++IO3—+ Cl2 + H2O=== NaIO4↓+ 2H++2Cl— ClO- + 2H+ + 2I-=== I2 + Cl- + H2O10 min时pH越低,c(H+)越大,反应速率加快(或ClO-氧化性增强),c(I2)越高,吸光度越大。 c(H+)较高,ClO-继续将I2 氧化为高价含碘微粒,c(I2)降低,吸光度下降 0.1
【解析】
(1)电解时,阳极失电子发生氧化反应,阴极得电子发生还原反应,两极合并为电解池总反应。
(2)a. Na2SO4与游离氯不反应,不能除去阳极液中游离氯;
b. Na2SO3有还原性,游离氯有强氧化性,两者发生氧化还原反应,则Na2SO3有可以除去阳极液中游离氯;
c.海水中提取溴用到“空气吹出法”将游离态的溴吹出,则除去阳极液中游离氯也可采取此方法;
d.由于气体的溶解度随压强的减小而减小,则降低阳极区液面上方的气压,游离氯的溶解度减小从液体中逸出,可除去阳极液中游离氯。
(3)①本小题考查的是对共价键的理解,碘元素和氯元素处于同一主族(VIIA),二者最外层电子数均为7,ICl中共用一对电子,由于碘原子半径大于氯原子,碘原子得电子能力弱于氯原子,故共用电子对偏离碘原子,使得碘元素显+1价。
②氧化还原反应中,物质中元素化合价升高失电子发生氧化反应,该物质作还原剂,生成的产物为氧化产物,物质中元素化合价降低得电子发生还原反应,该物质做氧化剂,生成的产物为还原产物,由此找出反应物和生成物,在根据得失电子守恒配平氧化还原反应。
(4)①本小题涉及速率的影响因素,增大反应物的浓度速率加快,则c(H+)越大,反应速率加快(或ClO-氧化性增强),c(I2)越高,吸光度越大。
②c(H+)较高,ClO-继续将I2 氧化为高价含碘微粒,c(I2)降低,吸光度下降。
③本小题涉及物质的量、物质的量浓度在氧化还原反应中的计算。
(1)电解饱和食盐水时,氯离子在阳极失电子发生氧化反应生成氯气,水电离的氢离子在阴极得电子发生还原反应生成氯气,则电解的化学方程式为2NaCl +2H2O ![]() C12↑+ H2↑+2NaOH。本小题答案为:2NaCl +2H2O
C12↑+ H2↑+2NaOH。本小题答案为:2NaCl +2H2O ![]() C12↑+ H2↑+2NaOH。
C12↑+ H2↑+2NaOH。
(2)a. Na2SO4与游离氯不反应,不能除去阳极液中游离氯,故a不符合题意;
b. Na2SO3有还原性,游离氯有强氧化性,两者发生氧化还原反应,则Na2SO3有可以除去阳极液中游离氯,故b符合题意;
c.海水中提取溴用到“空气吹出法”将游离态的溴吹出,则除去阳极液中游离氯也可采取此方法,故c符合题意;
d.由于气体的溶解度随压强的减小而减小,则降低阳极区液面上方的气压,游离氯的溶解度减小从液体中逸出,可除去阳极液中游离氯,故d符合题意。答案选bcd。
(3)①碘元素和氯元素处于同一主族(VIIA),二者最外层电子数均为7,ICl中共用一对电子,由于碘原子半径大于氯原子,碘原子得电子能力弱于氯原子,故共用电子对偏离碘原子,使得碘元素显+1价。本小题答案为:碘元素和氯元素处于同一主族(VIIA),二者最外层电子数均为7,ICl中共用一对电子,由于碘原子半径大于氯原子,碘原子得电子能力弱于氯原子,故共用电子对偏离碘原子,使得碘元素显+1价。
②NaIO3中I元素失电子发生氧化反应,化合价由+5价升高到+7价生成NaIO4,Cl2中氯元素得电子发生还原反应,化合价由0价降低到-1价生成Cl-,离子方程式为Na++IO3—+ Cl2 + H2O=== NaIO4↓+ 2H++2Cl—。本小题答案为:Na++IO3—+ Cl2 + H2O=== NaIO4↓+ 2H++2Cl—。
(4)①ClO- + 2H+ + 2I-=== I2 + Cl- + H2O 10 min时pH越低,c(H+)越大,反应速率加快(或ClO-氧化性增强),c(I2)越高,吸光度越大。本小题答案为:ClO- + 2H+ + 2I-=== I2 + Cl- + H2O 10 min时pH越低,c(H+)越大,反应速率加快(或ClO-氧化性增强),c(I2)越高(1分),吸光度越大。
②c(H+)较高,ClO-继续将I2 氧化为高价含碘微粒,c(I2)降低,吸光度下降。本小题答案为:c(H+)较高,ClO-继续将I2 氧化为高价含碘微粒,c(I2)降低,吸光度下降。
③研究表明食盐水中I-含量≤0.2 mgL-1时对离子交换膜影响可忽略。即1m3食盐水中I-的含量≤0.2 mgL-1×1m3×1000=0.2g时对离子交换膜影响可忽略,则1m3含I-浓度为1.47 mgL-1 的食盐水需处理掉1.47 mgL-1×1m3-0.2g=1.27g的I-时对离子交换膜影响可忽略。1.27gI-的物质的量为0.01mol,根据反应方程式ClO- + 2H+ + 2I-=== I2 + Cl- + H2O,需NaClO的物质的量为0.005mol,则此NaClO的体积为0.005mol/0.05mol/L=0.1L。本小题答案为:0.1。


科目:高中化学 来源: 题型:
【题目】最近美国学者成功实现用氮气和水生产氨,其装置如下图所示:
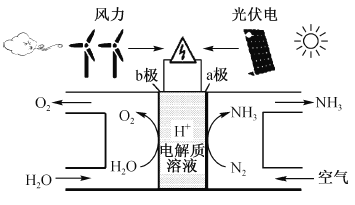
下列说法正确的是
A. 上图中的能量转化方式只有2种
B. a极发生的电极反应为N2 + 6H+ + 6e- = 2NH3
C. 装置工作时H+ 向b极区移动,电解质溶液pH减小
D. a极区与b极区产生的气体的物质的量之比为1 :1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常将一定量的有机物充分燃烧转化为简单的无机物,然后根据产物的质量确定有机物的组成。如图所示是用燃烧法确定有机物分子式的常用装置。
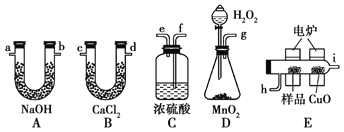
请回答下列问题:
(1)使产生的O2按从左到右的方向流动,则所选装置中各导管的正确连接顺序是________(填字母)。
(2)装置C中浓硫酸的作用是_____________________________________。
(3)燃烧管中CuO的作用是________________________________。
(4)若准确称取0.69 g样品(只含C、H、O三种元素中的两种或三种),充分燃烧后,A管质量增加1.32 g,B管质量增加0.81 g,则该有机物的实验式为________。
(5)要确定该有机物的分子式,还要知道该有机物的____,经测定其蒸气密度为 2.054 g/L(已换算为标准状况),则其分子式为______。
(6)该物质的核磁共振氢谱如图所示,则其结构简式为____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革 污泥中Cr(III)的处理工艺流程如下。
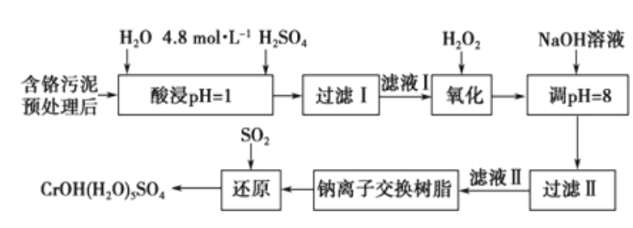
已知:①硫酸浸取后溶液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+;
②CrOH(H2O)5SO4难溶于水。
(1)浓H2O2溶液的作用是将滤液I中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:____________。
(2)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | - | - | - |
沉淀完全时的pH | 3.7 | 11.1 | 5.2 | 5.6 |
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为Cr2O42-,其离子方程式为______________________。此步骤中滤液的pH调至8,通过沉淀除去的金属离子为___________;此步骤中没有继续调高将Mg2+除去,理由是______________________。
(3)钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,利用该方法主要除去的滤液II中的Mg2+, 若测得滤液II通过钠离子交换柱后溶液中c(Na+)为amol/L,则滤液II中c(Mg2+)为___________。
(4)写出上述流程中用SO2进行还原时发生反应的离子方程式:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,X、Y、Z、W为短周期主族元素,W的原子序数是Z的2倍。下列说法中正确的是
X | Y | Z | ||
W |
A.简单离子半径:Y<Z
B.Y元素的最高价氧化物对应的水化物在一定条件下可以和X单质反应
C.氢化物的沸点:X<Z
D.WZ2具有漂白性,其漂白原理与双氧水相同
查看答案和解析>>
科目:高中化学 来源: 题型:
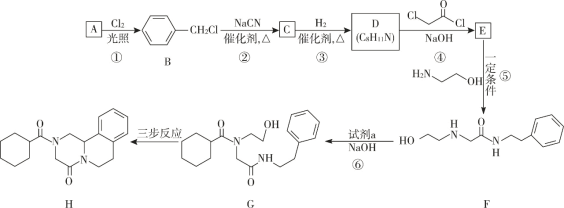
【题目】键线式是表达有机化合物结构的一种方式,如H2N—CH2—CH2—OH 用键线式可以表达为 ![]() 。吡喹酮(H)是一种治疗血吸虫病的药物,合成路线如下图所示:
。吡喹酮(H)是一种治疗血吸虫病的药物,合成路线如下图所示:
已知:I R-Cl+NaCN![]() R-CN+NaCl
R-CN+NaCl
ii 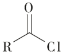 +R′—NH—R"+NaOH
+R′—NH—R"+NaOH![]()
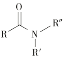 +NaCl+H2O(R、R′表示烃基,R"表示羟基或H)
+NaCl+H2O(R、R′表示烃基,R"表示羟基或H)
(1)A 属于芳香烃,其名称是____________ 。
(2)②的反应类型是_____________ 。
(3)B 的一种同分异构体,含苯环且核磁共振氢谱中出现三组峰,其结构简式为_____________ 。
(4)③中 1 mol C 理论上需要消耗 ___________mol H2 生成 D。
(5)④的化学方程式是_____________ 。
(6) 试剂 a 的结构简式是 ____________________。
(7) G→H 分为三步反应,J 中含有 3 个六元环,写出 I、J 的结构简式________________、__________________。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知溶液中,还原性HSO3>I-,氧化性IO3->I2。在含有3molNaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系如图所示,则下列说法中错误的是
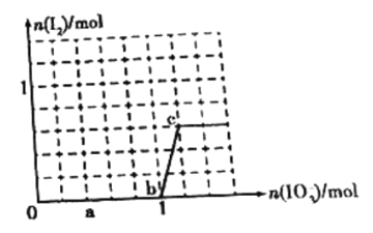
A. a点时NaHSO3剩余
B. b点时还原产物为I-
C. b点到c点,KIO3与NaHSO3反应生成I2
D. 加入的KIO3为0.4mol或1.12mol时,反应后溶液中I-均为0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL![]() 的HR溶液中逐滴滴入
的HR溶液中逐滴滴入![]() 的
的![]() 溶液,所得溶液pH及导电能力变化如图
溶液,所得溶液pH及导电能力变化如图![]() 下列分析不正确的是
下列分析不正确的是![]()
![]()
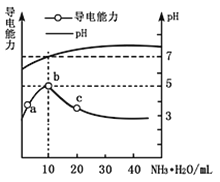
A. ![]() 点导电能力增强,说明HR为弱酸
点导电能力增强,说明HR为弱酸
B. b点溶液![]() ,此时酸碱恰好中和
,此时酸碱恰好中和
C. c点溶液存在![]() 、
、![]()
D. b、c两点水的电离程度:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com