
| A. | 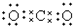 | B. | K+[${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$H]- | ||
| C. | 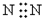 | D. |  |
分析 A、根据稳定结构判断,二氧化碳中碳原子与氧原子之间形成2对共用电子对;
B、氢氧化钾为离子化合物,钾离子与氢氧根是离子键,O与H形成共价键;
C、氮气分子中存在氮氮三键,氮原子最外层为8电子;
D、氨气分子的氮原子中含有孤电子对.
解答 解:A、二氧化碳中碳原子与氧原子之间形成2对共用电子对,电子式为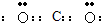 ,故A错误;
,故A错误;
B、氢氧化钾为离子化合物,由钾离子和氢氧根离子构成,氢氧化钾的电子式为: ,故B正确;
,故B正确;
C、N2,氮气中存在氮氮三键,氮原子最外层达到8电子稳定结构,氮气的电子式为 ,故C错误;
,故C错误;
D、氨气分子的电子式为: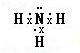 ,故D正确,故选BD.
,故D正确,故选BD.
点评 本题考查了电子式的书写,题目难度中等,注意掌握电子式的概念及表示方法,明确离子化合物与共价化合物的电子式的表示方法及区别.


科目:高中化学 来源: 题型:多选题
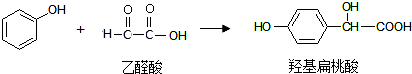
| A. | 羟基扁桃酸可以发生加成反应 | |
| B. | 上述反应属于取代反应 | |
| C. | 乙醛酸的核磁共振氢谱中有2个吸收峰 | |
| D. | 羟基扁桃酸能发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现用中和滴定法测定某盐酸溶液的浓度,有关数据记录如下:
现用中和滴定法测定某盐酸溶液的浓度,有关数据记录如下:| 实验编号 | 待测液体积/mL | 所消耗氢氧化钠标准液的体积/mL |
| 1 | 25.00 | 26.30 |
| 2 | 25.00 | 26.34 |
| 3 | 25.00 | 19.36 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫既可做氧化剂,又可做还原剂 | B. | SO3只有氧化性 | ||
| C. | 可以用铁罐贮运冷的浓H2SO4 | D. | H2S既有氧化性又有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 2%CuSO4溶液的体积 | 10%NaOH溶液的体积 | 振荡后 的现象 | pH | 加乙醛水浴加热后的沉淀颜色 |
| 1 | 2mL | 3滴 | 浅蓝绿色沉淀 | 5~6 | 浅蓝绿色沉淀 |
| 2 | a | 15滴 | 浅蓝色沉淀 | 7~8 | 黑色沉淀 |
| 3 | 1mL | 1mL | 蓝色悬浊沉淀较少 | 9~10 | 红褐色沉淀 |
| 4 | b | 2mL | 蓝色悬浊沉淀较多 | 11~12 | 红色沉淀 |
| 5 | 1mL | 3mL | 蓝紫色溶液 | 12~13 | ---- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 组别 | 物质 | 杂质 | 试剂 | 操作方法 |
| 1 | 乙烷 | 乙烯 | ||
| 2 | 溴苯 | 溴 | ||
| 3 | 乙酸乙酯 | 乙酸 | ||
| 4 | 乙醇 | 水 | ||
| 5 | 将重油转化为汽油 | |||
| 6 | 把煤转化为焦炉气、煤焦油和焦炭等 | |||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某校化学兴趣小组为探究FeSO4和NaHCO3的反应,按如图所示操作将NaHCO3溶液滴加到FeSO4溶液中(FeSO4和NaHCO3溶液均用经煮沸后冷却的蒸馏水配制,并在FeSO4溶液中加入少量铁粉).观察到试管中立即出现白色沉淀,同时有大量无色气体生成.
某校化学兴趣小组为探究FeSO4和NaHCO3的反应,按如图所示操作将NaHCO3溶液滴加到FeSO4溶液中(FeSO4和NaHCO3溶液均用经煮沸后冷却的蒸馏水配制,并在FeSO4溶液中加入少量铁粉).观察到试管中立即出现白色沉淀,同时有大量无色气体生成.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com