
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物。试回答下列问题:
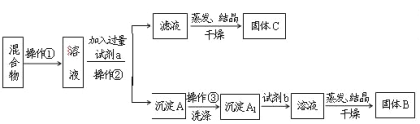
(1)操作①的名称是_________。操作②的名称是____________。
(2)试剂a是_________,试剂b是_________,固体B是________,固体C是________。
(3)加入试剂a所发生反应的离子方程式为:_________________________。
加入试剂b所发生反应的方程式为:____________________________。
(4)该方案能否达到实验目的:_____________。若不能,应如何改进(若能,此问不用回答)? _____________________。
(5)若要测定原混合物中BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是_____的质量。
【答案】(1)溶解 过滤
(2)K2CO3 MCl BaCl2 K2CO3和 KC1
(3)CO32-+Ba2+=BaCO3↓ BaCO3+2HCl=BaCl2+CO2↑+H2O
(4)否(不能)应在操作②的滤液中加入过量盐酸后再蒸发结晶
(5)沉淀A1或固体B
【解析】
试题分析:分离NaCl和BaCl2两种固体混合物,可先溶于水,然后加入过量Na2CO3使BaCl2转化为沉淀,过滤后沉淀加入盐酸可生成BaCl2溶液,经蒸发、结晶、干燥后可得固体BaCl2,操作②所得滤液为NaCl和Na2CO3的混合物,应加入过量盐酸可得NaCl;
(1)操作①的名称是溶解固体,操作②的名称是过滤;
(2)固体溶解后加入过量Na2CO3使BaCl2转化为沉淀,过滤后沉淀加入盐酸可生成BaCl2溶液,经蒸发、结晶、干燥后可得固体BaCl2,a为Na2CO3,b为盐酸,流程分析可知固体B为氯化钡,固体C是K2CO3和 KC1;
(3)加入过量Na2CO3使BaCl2转化为沉淀,试剂a为碳酸钠;发生的反应是钡离子和碳酸根离子反应生成沉淀碳酸钡,反应的离子方程式为:Ba2++CO32-═BaCO3↓,反应过程中试剂b为盐酸,是利用盐酸溶解碳酸钡得到氯化钡溶液,反应的离子方程式为:BaCO3+2H+=H2O+CO2↑+Ba2+;
(4)操作②所得滤液为NaCl和Na2CO3的混合物蒸发结晶干燥,得到固体C为氯化钠和碳酸钠的混合物,不能分离得到氯化钠,需要加入适量盐酸除去碳酸钠,到不再生成气体得到较纯净的氯化钠溶液,该方案不能达到实验目的;
(5)固体溶解后加入过量K2CO3使BaCl2转化为碳酸钡沉淀,过滤后沉淀加入试剂b盐酸可将碳酸钡转化成BaCl2溶液,然后经蒸发、结晶、干燥后可得固体BaCl2,若要测定原混合物中KCl和BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是固体B或沉淀A’的质量,依据B为BaCl2计算得到质量分数,A'为碳酸钡,结合钡元素守恒计算氯化钡质量得到。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】钇的常见化合价为+3价,我国蕴藏着丰富的含钇矿石(Y2FeBe2Si2O10),工业上通过如下生产流程可获得氧化钇。
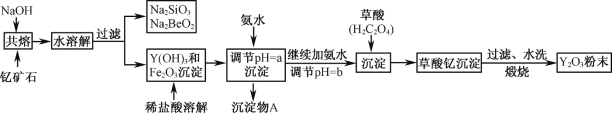
已知:①该流程中有关金属离子形成氢氧化物沉淀时的pH见下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH | |
Fe3+ | 2.7 | 3.7 | |
Y3+ | 6.0 | 8.2 | |
②在元素周期表中,铍元素和铝元素处于第二周期和第三周期的对角线位置,化学性质相似。请回答下列问题:
(1)欲从Na2SiO3和Na2BeO2混合溶液中制得Be(OH)2沉淀。
① 最好选用盐酸和 两种试剂,再通过必要的操作即可实现。
A.NaOH溶液 B.氨水 C.CO2 D.HNO3
② 写出Na2BeO2与足量盐酸发生反应的离子方程式 。
(2)为使Fe3+沉淀完全,用氨水调节pH=a时,a应控制在 范围内;继续加氨水调节pH =b发生反应的离子方程式为 ;检验Fe3+是否沉淀完全的操作方法是 。
(3)煅烧草酸钇时发生分解反应,其固体产物为氧化钇,气体产物能使澄清石灰水变浑浊。写出草酸钇[Y2(C2O4)3.nH2O]煅烧的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在25℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,则该反应的热化学方程式为 。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) ΔH=-24.8 kJ/mol ①
3Fe2O3(s)+CO(g) = 2Fe3O4(s)+CO2(g) ΔH=-47.2 kJ/mol ②
Fe3O4(s)+CO(g) = 3FeO(s)+CO2(g) ΔH=+640.5 kJ/mol ③
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.6 kJ·mol-1。
2NH3(g) ΔH=-92.6 kJ·mol-1。
实验测得起始、平衡时的有关数据如下表所示:
容器 | 起始时各物质的物质的量/mol | 达平衡时体系能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15 kJ |
② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述错误的是
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数相等
C.若容器①的体积为0.5 L,则平衡时放出的热量小于23.15 kJ
D.容器②中达平衡时放出的热量Q=23.15 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】充分燃烧一定量的丁烷气体放出的热量为Q,完全吸收它生成的CO2气体生成正盐,需5 mol·L-1的NaOH溶液100 mL,则丁烷的燃烧热为
A.16Q B.8Q C.4Q D.2Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由水电离出来的氢离子浓度为10-13 mol/L,在此溶液中一定能大量共存的离子组是
A. ClO—、K+、Cl— B. Ba2+、Na+、Br—
C. Na+、Fe3+、SO42— D. K+、NO3—、NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释实验事实的方程式正确的是
A.用氢氧化钠溶液去除铝条表面的氧化膜:Al2O3+2OH—=2AlO2—+H2O
B.铜片溶于稀硝酸产生无色气体:Cu+4H++2NO3—=Cu2++2NO2↑+2H2O
C.氢氧化亚铁在空气中变质:2Fe(OH)2+O2+2H2O=2Fe(OH)3
D.碳酸钠溶液呈碱性:CO32—+2H2O![]() H2CO3+2OH—
H2CO3+2OH—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(除标注外,其余每空1分,共7分)X、Y、Z、Q、R、T、U、W分别代表原子序数依次增大的前四周期元素。X和R属同族元素;Z和U位于第VIIA族;X和Z可形成化合物XZ4;Q基态原子的s轨道和p轨道的电子总数相等;T的一种单质在空气中能够自燃。W的外围电子排布式为3d63s2。
请回答下列问题:
(1)R基态原子的电子排布式是_________。W在元素周期表的位置是_____________。
(2)XU4的电子式是_____________,用一个离子方程式证明S(硫)元素和U元素的非金属性的强弱_____________。
(3)CuSO4溶液能用作T4中毒的解毒剂,反应可生成T的最高价含氧酸和铜,该反应的化学方程式是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在人体细胞中对生命活动起着重要作用,含量约占细胞鲜重总量97%的化学元素是
A. C、H、O、N、P、Ca B. C、H、O、N、P、K
C. C、H、O、N、S、K D. C、H、O、N、P、S
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com