
����Ŀ�����ڻ�ѧ��Ӧ���ʺ��ȣ�����˵����ȷ���ǣ�
A. �ܱ������н��е����·�Ӧ��2X(g)+Y(g)![]() Z(g)+W(s) ��H��0�������¶ȣ�����Ӧ���������淴Ӧ���ʼ�С
Z(g)+W(s) ��H��0�������¶ȣ�����Ӧ���������淴Ӧ���ʼ�С
B. ���ڷ�Ӧ��H2S(g) ![]() H2(g)��S(s)����H��0 ����ѹ���¶���ʹ��ѧƽ�����淴Ӧ�����ƶ�
H2(g)��S(s)����H��0 ����ѹ���¶���ʹ��ѧƽ�����淴Ӧ�����ƶ�
C. һ�������£�2L �ܱ������д��ڷ�Ӧ��CO(g)+H2O(g)![]() CO2(g)+H2(g) ��H��0����ƽ����ٳ���һ������CO(g)��ƽ�������ƶ���ƽ�ⳣ��K���
CO2(g)+H2(g) ��H��0����ƽ����ٳ���һ������CO(g)��ƽ�������ƶ���ƽ�ⳣ��K���
D. ����Ӧ���Ũ�ȣ�ƽ�������ƶ���������İٷֺ�����һ������
���𰸡�D
��������
A. 2X(g)+Y(g)![]() Z(g)+W(s) ��H��0�������¶ȣ�����Ӱٷ������ӡ����淴Ӧ���ʾ�����A����
Z(g)+W(s) ��H��0�������¶ȣ�����Ӱٷ������ӡ����淴Ӧ���ʾ�����A����
B. ���ڷ�Ӧ��H2S(g) ![]() H2(g)��S(s)����H��0 ����ѹƽ�������ƶ������»�ѧƽ�����淴Ӧ�����ƶ�����B����
H2(g)��S(s)����H��0 ����ѹƽ�������ƶ������»�ѧƽ�����淴Ӧ�����ƶ�����B����
C.ƽ�ⳣ��K�������ֻ���¶�Ӱ�죬�¶Ȳ��䣬ʼ���Ƕ�ֵ����C����
D.����Ӧ���Ũ�ȣ�ƽ�������ƶ���������İٷֺ���=![]() ����Ϊ���ӣ���ĸ����������������İٷֺ�����һ������D��ȷ��
����Ϊ���ӣ���ĸ����������������İٷֺ�����һ������D��ȷ��
��ȷ�𰸣�D��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ư����������(NaClO2)�ڳ�����ڰ����ɱ���һ�꣬������ȶ��ɷֽ⣬��Ӧ�����ӷ���ʽΪ��5HClO2===4ClO2����H����Cl����2H2O��(HClO2Ϊ����)��NaClO2��Һ�еμ�H2SO4����ʼʱHClO2�ֽⷴӦ���������ӦѸ�ټӿ죬��ԭ����
A. ��Һ�е�Cl��������� B. ��Һ�е�H���������
C. ClO2�ݳ���ʹ��Ӧ��������Ũ�Ƚ��� D. �����������£��������Ƶ���������ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(CH3OCH3)��һ��������Դ��
��֪����CO(g)��2H2(g)![]() CH3OH(g) ��H1����99kJ��mol-1
CH3OH(g) ��H1����99kJ��mol-1
��2CH3OH(g)![]() CH3OCH3(g)��H2O(g) ��H2����24kJ��mol-1
CH3OCH3(g)��H2O(g) ��H2����24kJ��mol-1
��CO(g)��H2O(g)![]() CO2(g)��H2(g) ��H3����41kJ��mol-1
CO2(g)��H2(g) ��H3����41kJ��mol-1
�ش��������⣺
��1��д��CO��H2��Ӧ����CO2��CH3OCH3(g)���Ȼ�ѧ����ʽ_____��
��2�����м�����߷�Ӧ���� CO ��ƽ��ת���ʣ���������Ӧ���ʵ���____�����ţ���
a������ѹǿ b�������¶� c������H2Ũ�� d���Ӹ�Ч����
��3����ij���º��������з�����Ӧ�ۣ���˵���÷�Ӧ�ﵽƽ�����___�����ţ���
a������ƽ����Է����������ֲ���
b����H3���ֲ���
c��![]() ���ֲ���
���ֲ���
d�������ܶȱ��ֲ���
��4����һ���¶ȣ�T�棩�£�������ܱ�������ͨ��һ����CH3OH���壬ֻ������Ӧ�ڡ�����������CH3OCH3 �����ʵ�������[��(CH3OCH3)]�뷴Ӧʱ��(t)�й����������ʾ��
t/min | 0 | 15 | 30 | 45 | 80 | 100 |
��(CH3OCH3) | 0 | 0.05 | 0.08 | 0.09 | 0.10 | 0.10 |
�ٸ��¶��£�������Ӧ��ƽ�ⳣ��KΪ___���÷�����ʾ����
�ڷ�Ӧ����v��v����v��������v����k������2(CH3OH)��v����k������(CH3OCH3)����(H2O)��k����k ���ֱ�Ϊ�����淴Ӧ���ʳ�����![]() ֻ���¶��йء�15minʱ����___���������2λС������
ֻ���¶��йء�15minʱ����___���������2λС������
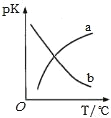
��5�����ܱ������з�����Ӧ�ۣ�ƽ�ⳣ��ΪK��pK��pK����lgK�����¶ȵĹ�ϵ��ͼ��ʾ��ͼ������___���a����b�����ܷ�ӳƽ�ⳣ���仯���ơ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵������ȷ����
A. ����H2ʹ0.1molCuO��ԭΪCuʱת�Ƶĵ�����Ϊ0.2NA
B. 32gS8(���ӽṹ��![]() )�еĹ��ۼ���ĿΪNA
)�еĹ��ۼ���ĿΪNA
C. 2g��H218O��2H2O��ɵĻ�����к��е�������ΪNA
D. ��״���£�11.2LCl2����ˮ����Һ��Cl����ClO����HClO������֮��ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1.28gͭͶ��һ������Ũ�����У�ͭ��ȫ�ܽ⣬����������ɫԽ��Խdz�����ռ���VmL���壨��״��������ʢ�д����������������ˮ�У�ͨ������ǡ��ʹ������ȫ�ܽ���ˮ�У�����Ҫ��״���µ��������Ϊ(����)
A. 504mLB. 336mLC. 224mLD. 168mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Դ�ḻ����̼ԭ�������ٵ���Ϊԭ�Ϻϳ����������ĸ߷��Ӳ��Ͼ�����ʵ���塣�Լ������C�ϳ����ָ߷��Ӳ���B��F(FΪ������߷��ӻ�����)��·����ͼ��
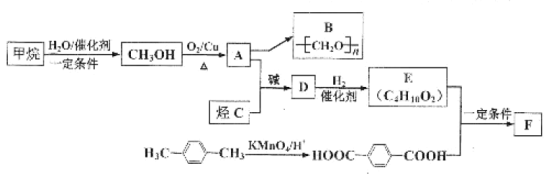
��֪����H-C![]() C-H+2
C-H+2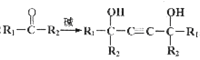 ��
��
����C������ͼ��ͼ��ʾ��
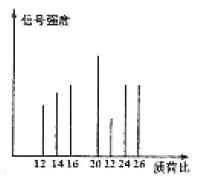
��ش��������⣺
��1���л���A��B�ķ�Ӧ������__(�����Ӿۡ�����������)��Ӧ����C�Ľṹ��ʽΪ___��
��2��![]() �Ļ�ѧ����Ϊ___�����以Ϊͬ���칹�ķ���������___�֡�
�Ļ�ѧ����Ϊ___�����以Ϊͬ���칹�ķ���������___�֡�
��3���л���D����������������Ϊ____
��4��д��Dת��ΪE�Ļ�ѧ����ʽ_____
��5��F�Ľṹ��ʽΪ__����F��ƽ����Է�������Ϊ10000������ƽ���ۺ϶�ԼΪ___(����ĸ���)��
a.45 b.56 c.66 d.69
��6���������Ϻϳ�·�ߣ�����C��������Ϊ�л�ԭ��(���Լ���ѡ)������Ʊ��л�������H3C��CH(OH)��C��C��CH(OH)��CH3�ĺϳ�·�ߣ�___
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͨˮ���ڹ̻�������������ˮ���Ӽ��ٲ��γɼ�����Һ��������һ������ѧ�ص㣬��ѧ�ҷ����˵綯�Ʒ���ˮ��ij���ʱ�䡣�˷���ԭ����ͼ��ʾ����Ӧ���ܷ���ʽΪ2Cu+Ag2O=Cu2O+2Ag�������й�˵����ȷ����( )

A. ����ԭ��ʾ��ͼ�У����������Cu����Ag2O
B. �����ĵ缫��ӦʽΪ2Cu+2OH--2e-=Cu2O+H2O
C. ��ع���ʱ��OH-�������ƶ�
D. 2molCu��1molAg2O������������1molCu2O��2molAg���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijЩ�л��������ģ����ͼ��ʾ���ش��������⣺
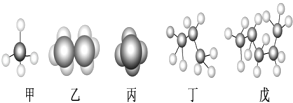
��1�����ڱ���ģ�͵���___����������������������������������������������ͬ����
��2����ʾͬһ���л����������___��
��3������ͬ���칹�����___��д����ͬ���칹��Ľṹ��ʽ___��
��4����̼����͵���___����������͵ķ�������Ԫ�ص������ٷֺ�����___������һλС������
��5��C8H10���ڱ���ͬϵ�������ͬ���칹�干��___�֡�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��(N2H4)�ֳ���������һ�ֿ�ȼ�Ե�Һ�壬���������ȼ�ϣ���֪��101kPaʱ��32.0gN2H4����������ȫȼ�����ɵ������ų�����624kJ(25��ʱ)��N2H4��ȫȼ�շ�Ӧ���Ȼ�ѧ����ʽ�ǣ�_________________��
(2)Li��SOCl2��ؿ����������������õ�صĵ缫���Ϸֱ�Ϊ﮺�̼�����Һ��LiAlCl4��SOCl2����ص��ܷ�Ӧ�ɱ�ʾΪ��4Li+2SOCl2=4LiCl+S+SO2������ش��������⣺
��SOCl2�ӷ���ʵ�����г���NaOH��Һ����SOCl2����Na2SO3��NaCl���ɣ����������ˮ�ε�SOCl2�У���Ӧ�Ļ�ѧ����ʽΪ______��
����װ�õ�ر�������ˮ�������������½��У�ԭ����______��
(3)����ͼ��һ���绯ѧ����ʾ��ͼ
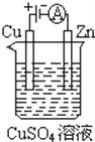
��пƬ�Ϸ����ĵ缫��Ӧ��______��
�ڼ���ʹ��Li��SOCl2�����Ϊ�������еĵ�Դ��ͭƬ�������仯Ϊ128g����Li��SOCl2�������������Li������______g��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com