
【题目】(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是:_________________。
(2)Li﹣SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4﹣SOCl2.电池的总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2↑.请回答下列问题:
①SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成.如果把少量水滴到SOCl2中,反应的化学方程式为______。
②组装该电池必须在无水、无氧的条件下进行,原因是______。
(3)如下图是一个电化学过程示意图
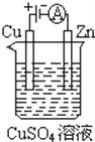
①锌片上发生的电极反应是______。
②假设使用Li﹣SOCl2电池作为本过程中的电源,铜片的质量变化为128g,则Li﹣SOCl2电池理论上消耗Li的质量______g。
【答案】N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624kJ/mol SOCl2+H2O=SO2↑+2HCl↑ 锂是活泼金属,易与H2O、O2反应;SOCl2也可与水反应 Cu2++2e-=Cu 28g
【解析】
(1)根据肼和反应热的关系计算出其燃烧热,并写出其相应的热化学方程式;
(2)①根据SOCl2与NaOH溶液反应的生成物确定SOCl2与水反应的生成物,根据与水反应生成物的性质判断反应现象,从而写出与水反应的方程式;
②根据类比钠的活泼性判断锂的活泼性,根据锂的活泼性以及SOCl2的性质分析;
(3)①锌片连接电源的负极,作阴极,发生还原反应;
②根据同一闭合回路中转移电子数目相等,分析解答。
(1)32.0g肼的物质的量为n(N2H4)=32.0g÷32g/mol=1mol,1molN2H4在氧气中完全燃烧生成氮气放出热量624kJ,所以其热化学反应方程式为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624kJ/mol;
(2)①根据NaOH和SOCl2生成Na2SO3和NaCl两种盐可知:SOCl2和水生成酸或酸性氧化物,根据原子守恒得,SOCl2和水生成SO2和HCl,反应方程式为为:SOCl2+H2O=SO2↑+2HCl↑;
②由于锂和钠是同一主族的元素,二者化学性质具有相似性,钠和空气中的氧气、水蒸气反应,因此锂和空气中的氧气、水蒸气也能反应;且SOCl2也可与水反应,所以组装该电池必须在无水、无氧的条件下进行;
(3)①根据装置图可知:锌片与外接电源的负极连接,作阴极,发生还原反应,电极反应式为:Cu2++2e-=Cu;
②铜片连接电源的正极,作阳极,发生氧化反应,Cu是+2价的金属,铜片质量变化128g,转移电子的物质的量n(e-)=![]() ×2=4mol,Li是+1价的金属,所以反应消耗Li的质量质量为m(Li)=4mol×7g/mol=28g。
×2=4mol,Li是+1价的金属,所以反应消耗Li的质量质量为m(Li)=4mol×7g/mol=28g。


科目:高中化学 来源: 题型:
【题目】关于化学反应速率和限度,下列说法正确的是:
A. 密闭容器中进行的如下反应:2X(g)+Y(g)![]() Z(g)+W(s) ΔH>0,升高温度,正反应速率增大,逆反应速率减小
Z(g)+W(s) ΔH>0,升高温度,正反应速率增大,逆反应速率减小
B. 对于反应:H2S(g) ![]() H2(g)+S(s) ΔH>0 ,加压或降温都能使化学平衡向逆反应方向移动
H2(g)+S(s) ΔH>0 ,加压或降温都能使化学平衡向逆反应方向移动
C. 一定条件下,2L 密闭容器中存在反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H<0。达平衡后再充入一定量的CO(g),平衡正向移动,平衡常数K变大
CO2(g)+H2(g) △H<0。达平衡后再充入一定量的CO(g),平衡正向移动,平衡常数K变大
D. 增大反应物的浓度,平衡向右移动,生成物的百分含量不一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验现象所得出的结论不正确的是
选项 | 实验现象 | 实验结论 |
A | 将铝片分别投入浓、稀硝酸中, 前者无明显现象,后者反应剧烈 | 稀硝酸的氧化性比浓硝酸的强 |
B | 向滴有酚酞的Na2CO3溶液中 加入BaCl2溶液,红色变浅 | Na2CO3溶液中存在水解平衡 |
C | 某溶液中滴加过量氨水产生 白色沉淀且不溶解 | 该溶液中可能含有Mg2+ |
D | 溴水中通入SO2,溴水褪色 | SO2具有还原性 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为比较Fe3+和Cu2+对H2O2分解反应的催化效果,两位同学分别设计了如图甲、乙所示的实验。下列叙述不正确的是( )
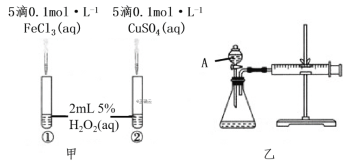
A.图甲所示实验可通过观察产生气泡的快慢来比较反应速率的大小
B.若图甲所示实验中反应速率为①>②,则说明Fe3+一定比Cu2+对H2O2分解的催化效果好
C.用图乙所示装置测定反应速率,可测定反应产生的气体体积及反应时间
D.为检查图乙所示装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密封容器中发生可逆反应:X2+Y2![]() 2Z,已知起始时X2、Y2、Z的物质的量浓度分别为0.1mol/L,0.3mol/L,0.2mol/L。反应在一定条件下进行到某一时刻时,各物质的物质的量浓度可能是( )
2Z,已知起始时X2、Y2、Z的物质的量浓度分别为0.1mol/L,0.3mol/L,0.2mol/L。反应在一定条件下进行到某一时刻时,各物质的物质的量浓度可能是( )
A.c(X2)=0.2mol/LB.c(Y2)=0.35mol/LC.c(Y2)=0.2mol/LD.c(Z)=0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的说法不正确的是
A. 用如图电子天平称量固体,读数时侧门应关闭

B. 用托盘天平称取10.2 g NaOH固体时,将10g的砝码放在右盘,将游码移到0.2g的位置
C. 分光光度计可用于分析溶液颜色与反应物(生成物)浓度的关系,从而确定化学反应速率
D. 吸入氯气、氯化氢气体时,可吸入少量酒精或乙醚的混合蒸气解毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各性质中符合图示关系的是
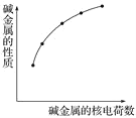
①化合价 ②ROH的碱性 ③密度 ④最外层电子数 ⑤核外电子层数 ⑥单质失e-能力
A.②④⑤⑥B.②⑤⑥C.②③⑤⑥D.①②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应与能量变化的说法正确的是
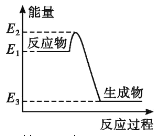
A. 如图所示的化学反应中,反应物的键能之和大于生成物的键能之和
B. 相同条件下,氢气和氧气反应生成液态水比生成等量的气态水放出的热量少
C. 金刚石在一定条件下转化成石墨能量变化如图所示,热反应方程式可为:C(s金刚石) =C(s,石墨) H=-(E2—E3)kJ·mol—1
D. 同温同压下,H2(g)+C12(g)==2HCl(g)能量变化如图所示,在光照和点燃条件下的△H相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa=-lgKa,25℃时,H2SO3的 pKa1=1.85,pKa2=7.19.用0.1molL-1NaOH溶液滴定20mL0.1molL-1H2SO3溶液的滴定曲线如图所示(曲线上的数字为pH).下列说法不正确的是( )

A.a点所得溶液中:2c(H2SO3)+c(SO32-)<0.1 molL-1
B.b点所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-)
C.c点所得溶液中:c(Na+)<3c(HSO3 )
D.d点所得溶液中:c(Na+)>c(SO32-)>c(HSO3-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com