
(16分)
甲、乙两个实验小组分别进行“测定Na2CO3和NaCl混合物中Na2CO3含量”的实验。
(1)甲组:沉淀分析法:
把一定量的混合物溶解后加入过量CaCl2,然后将所得沉淀过滤、洗涤、烘干、称量。确定CaCl2溶液是否过量的方法是 洗涤沉淀并判断沉淀是否洗净的操作是_____________________________。
(2)乙组:气体分析法:
把一定量的混合物与足量盐酸反应后,用如图装置测定产生的CO2气体的体积,为减小CO2的溶解,B中溶液应是____________,选用该溶液后实验结果还是不准确,原因是_________________。
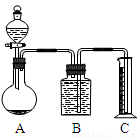
(3)请你设计一个与甲、乙两组操作不同的实验方案,
测定混合物中Na2CO3的含量。
方法: ;
试剂:_________________________________________________________________。
用到的玻璃仪器:_____________________________________________(至少2件)。
(16分)
(1)静置,向上层清液中继续滴加CaCl2溶液,若无沉淀说明CaCl2已过量 (2分);
沿玻棒向过滤器中的沉淀上加蒸馏水至淹没沉淀,静置使其全部滤出,重复2~3次,然后向滤液(洗涤液)中滴加AgNO3溶液判断是否洗净。(4分,每要点1分)
(2)饱和NaHCO3溶液;从A出来的气体中混有HCl,会与NaHCO3反应生成CO2(2+2分)
(3)滴定分析法(或中和滴定法、滴定法、用标准盐酸滴定一定量的混合物等)(2分)、 标准盐酸溶液、指示剂(甲基橙、酚酞) (2分) ; 酸式滴定管、锥形瓶、烧杯 (2分,答对其中2种即可得2分)。(学生的作答只要是合理的,均可酌情给分)
【解析】


科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:2011-2012年黑龙江哈三中高二上学期期中考试化学(理)试卷 题型:实验题
(10分,每空2分)甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素。
(1)该反应的离子方程式为(提示:H2C2O4的一级电离平衡常数为5.4×10-2)
。
设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
(2)甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小。 实验装置如图,实验时分液漏斗中A溶液一次性放下,A、B的成分见下表:
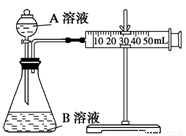
|
序号 |
A溶液 |
B溶液 |
|
① |
2 mL 0.1 mol/L H2C2O4溶液 |
4 mL 0.01 mol/L KMnO4溶液 |
|
② |
2 mL 0.2 mol/L H2C2O4溶液 |
4 mL 0.01 mol/L KMnO4溶液 |
|
③ |
2 mL 0.2 mol/L H2C2O4溶液 |
4 mL 0.01 mol/L KMnO4溶液和少量MnSO4 |
该实验探究的是 对化学反应速率的影响。在反应停止之前,相同时间内针管中所得CO2的体积由大到小的顺序是 (用实验序号填空)。
(3)乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率的大小。
取两支试管各加入2 mL 0.1 mol/L H2C2O4溶液,另取两支试管各加入4 mL 0.1 mol/L KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间。该实验目的是研究 对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是 。
查看答案和解析>>
科目:高中化学 来源:0114 期中题 题型:实验题

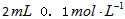 H2C2O4溶液,另取两支试管各加入
H2C2O4溶液,另取两支试管各加入 KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间。该实验试图探究__________对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是_____________________________________。
KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间。该实验试图探究__________对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是_____________________________________。 查看答案和解析>>
科目:高中化学 来源: 题型:
已知KMnO4和H2C2O4在酸性溶液中发生反应:
KMnO4+ H2C2O4+ H2SO4 — K2SO4+ MnSO4+ CO2↑+ H2O(请配平)。
甲、乙两个实验小组欲探究影响化学反应速率的因素,设计实验方案如下:
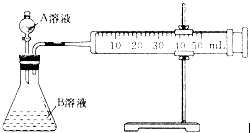
(1)甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小,实验装置如图所示。
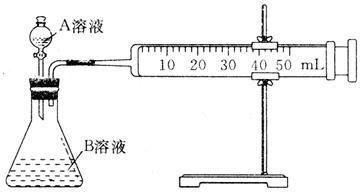
实验时A溶液一次性放下,A,B的成分见下表:
| 序号 | A溶液 | B溶液 |
| ① | 2mL 0.1 mol·L-1 H2C2O4溶液 | 4mL 0.01 mol·L-1 KMnO4溶液 |
| ② | 2mL 0.2 mol·L-1 H2C2O4溶液 | 4mL 0.01 mol·L-1 KMnO4溶液 |
| ③ | 2mL 0.2 mol·L-1L H2C2O4溶液 | 4mL 0.01 mol·L-1 KMnO4溶液、少量催化剂 |
该实验探究的是 对化学反应速率的影响。在反应停止之前,相同时间内针筒中所得CO2的体积由大到小的顺序是 (用实验序号填空)。
(2)乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率的大小。取两支试管各加入2![]() 0.1
0.1![]() H2C2O4溶液,另取两支试管各加入4
H2C2O4溶液,另取两支试管各加入4![]() 0.1
0.1![]() KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间。该实验试图探究 对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是 。
KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间。该实验试图探究 对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)已知KMnO4和H2C2O4(草酸)在酸性溶液中会发生如下反应:
2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
 甲、乙两个实验小组欲探究影响化学反应速率的因素,设计
甲、乙两个实验小组欲探究影响化学反应速率的因素,设计
实验方案如下(实验中所用KMnO4溶液均已酸化):
(1)甲组:通过测定单位时间内生成CO2气体体积的量来比
较化学反应速率,实验装置如图,实验时分液漏斗中A溶
液一次性加入,A、B的成分见下表:
| 序号 | A溶液 | B溶液 |
| ① | 2mL 0.1 mol·L-1H2C2O4溶液 | 4mL 0.01 mol·L-1KMnO4溶液 |
| ② | 2mL 0.2 mol·L-1 H2C2O4溶液 | 4mL 0.01 mol·L-1 KMnO4溶液 |
| ③ | 2mL 0.2 mol·L-1 H2C2O4溶液 | 4mL 0.01 mol·L-1 KMnO4溶液 少量MnSO4(催化剂) |
该实验探究的是 因素对化学反应速率的影响。在反应停止之前,相同时间内针筒中所得CO2的体积由大到小的顺序是 (填实验序号)。
(2)乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率。
取两支试管各加入2 mL 0.1 mol·L-1H2C2O4溶液,另取两支试管各加入4 mL 0.1 mol·L-1 KMnO4溶液。将四支试管分成两组(每组各有一支盛有H2C2O4溶液和KMnO4溶液),一组放入冷水中,另一组放入热水中,一段时间后,分别混合并振荡,记录溶液褪色所需时间。该实验试图探究
因素对化学反应速率的影响,但该组同学始终没有看到溶液完全褪色,其原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com