
【题目】在一定温度下,容器内某反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是

A. t3时,正反应速率大于逆反应速率
B. t2时,正逆反应速率相等,反应达到平衡状态
C. 化学方程式为:2M= N
D. t1时,N的浓度是M浓度的2倍
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】H2S 分子结构和 H2O 相似,但 S-H 键键能比 O-H 键键能低。下列判断错误的是
A. H2S 分子呈折线型 B. H2S 分子是极性分子
C. H2S 沸点低于 H2O,因为 S-H 键键能低 D. H2S 分子稳定性低于 H2O 分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用钛白工业的副产品FeSO4(含Al2(SO4)3和少量重金属离子)可以生产电池级高纯超微细草酸亚铁。其工艺流程如下:

已知:①5Fe2++ MnO4-+8H+=5Fe3++Mn2++4H2O
5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有 。
(2)滤液经处理可得到副产品 。
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入25 mL 2 mol·L-1的H2SO4溶解。
步骤2:用0.2000 mol·L-1标准KMnO4溶液滴定,消耗其体积30.40 mL。
步骤3:向滴定后的溶液中加入2 g Zn粉和5 mL 2 mol·L-1的H2SO4溶液,将Fe3+还原为Fe2+。
步骤4:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液10.00 mL。
则样品中C2O42-的物质的量为 。(写出计算过程)
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应 液中Mn2+的浓度随反应时间t的变化如图,其变化趋势的原因可能为 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关甲烷的说法不正确的是( )
A. 甲烷分子中四个碳氢键键长相等
B. 甲烷分子中四个碳氢键键角相等
C. 甲烷分子中四个碳氢键键能相等
D. 由于甲烷分子三个键参数都分别相等,所以甲烷的空间构型是平面正方形结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某烃类物质A的结构,进行如下实验。
(1)将有机物A置于足量氧气中充分燃烧,将生成物通过浓硫酸,浓硫酸增重7. 2克,再将剩余气体通过碱石灰,减石灰增重17.6克;则物质A中各元素的原子个数比是________________;
(2)质谱仪测定有机化合物A的相对分子质量为56,则该物质的分子式是____________;
(3)根据碳原子和氢原子的成键特点,预测能够使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色的A的可能结构并写出结构简式______________。(含顺反异构)
(4)经核磁共振氢谱测定,有机物A分子内有4种氢原子,则用方程式解释A使溴的四氯化碳溶液褪色的原因:______________,反应类型:________________;A也可能合成包装塑料,请写出相关的化学反应方程式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尿素[CO(NH2)2]是首个由无机物人工合成的有机物。
(1)工业上用CO2和NH3在一定条件下合成,其反应方程式__________。
(2)在一个2L的密闭容器内,当起始投入量氨碳比![]() =4,CO2的转化率随时间的变化关系如下图所示。
=4,CO2的转化率随时间的变化关系如下图所示。
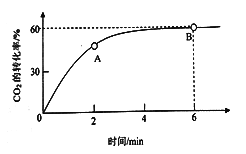
① A点的逆反应速率v逆(CO2) __________________B点的正反应速率为v正(CO2)(填“大于”、“小于”或“等于”)
②假设氨的起始投入量为8mol,求从开始到达到平衡状态这段时间内v(NH3)=_________________。
③NH3的平衡转化率为____________________。
④单纯从制备的成本角度考虑,我们希望氨碳比![]() 尽可能__________(“大”、“小”)因为_________。
尽可能__________(“大”、“小”)因为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(16分)某强酸性溶液X,含Ag+、Al3+、SiO2-3、NH+4、Fe2+、Fe3+、CO2-3、Cl-、NO-3中的一种或几种离子,取X溶液进行连续实验,能实现如下转化:

依据以上信息,回答下列问题:
(1)上述离子中,溶液x中肯定含有的是: ;不能肯定的是: ;对不能确定是否存在的离子,可以另取x溶液于一支试管中,选择下列试剂中的某一种加入X溶液,根据现象就可判断,则试剂可以选(若多种选法中间加“或"字间隔): 。
①酚酞试剂,②石蕊试剂,③pH试纸,④KSCN溶液,⑤KMnO4溶液,⑥苯酚溶液
(2)气体G的化学式为: ;沉淀E的化学式为: ;沉淀J的化学式为: 。
(3)实验中,产生的气体A为无色,但如果暴露在空气中可以观察到的现象是: ;写出步骤①中生成气体A的离子方程式 。
(4)要使步骤②中,A、H2O、O2三种物质恰好发生化合反应,则A、H2 O、O2物质的量之比是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是CH4、CCl4、CH3Cl (沸点:-24.2℃)的球棍模型图。下列说法正确的是( )
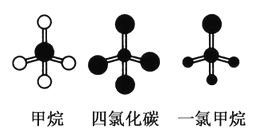
A. CH4、CCl4和CH3C1都是正四面体结构
B. 标准状况下,2.24L一氯甲烷含有的分子数为6.02×1022
C. 甲烷与氯气的取代反应,生成的产物中CH3C1最多
D. 四氯化碳是一种常见的有机溶剂,密度比水小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com