
����Ŀ��������ﮣ�LiAlH4������Ϊ�л��ϳɵ���Ҫ��ԭ������ҵ���Ի�﮿���Ҫ�ɷ���LiAlSi2O6��������Fe2O3��Ϊԭ�Ϻϳ�������﮵�������ͼ��
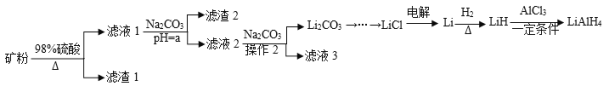
��֪�������������������pH���±���ʾ��
���� | Fe(OH)3 | Al(OH)3 |
��ʼ������pH | 2.3 | 4 |
��ȫ������pH | 3.7 | 6.5 |
��ش�
��1��д��LiAlSi2O6�����ᷴӦ�Ļ�ѧ����ʽ__������2����Ҫ�ɷ�Ϊ__���ѧʽ������a������СֵΪ__��
��2����֪Li2CO3����ˮ���䱥����Һ��Ũ�����¶ȹ�ϵ���±���ʾ������2�У�����Ũ���������ȹ��ˣ���ԭ����__��90��ʱKsp(Li2CO3)��ֵΪ__��
�¶�/�� | 10 | 30 | 60 | 90 |
Ũ��/mol��L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
��3����������LiC1�Ʊ�����Li�ĵ��������__��
��4��Ϊ�ⶨ�Ʊ���������ﮣ�LiAlH4���Ĵ��ȣ���ȡ��Ʒag����ˮʹ����ȫ��Ӧ���ռ������������VmL��
��LiAlH4�ܽ�ʱ������Ӧ�Ļ�ѧ����ʽΪ__��
����Ʒ�Ĵ���Ϊ__���г���ѧ����ʽ���ɣ���
���𰸡�2LiAlSi2O6+4H2SO4=Li2SO4+Al2(SO4)3+4H2SiO3�� Fe(OH)3��Al(OH)3 6.5 Li2CO3�ܽ�����¶����{�����ͣ�����Ũ������ȹ��ˣ��ܼ���Li2CO3���ܽ���ʧ 4.0��10-3 Pt�ȶ��Ե缫�����ڵ�LiCl LiAlH4+4H2O=LiOH+Al(OH)3+4H2�� ![]() %
%
��������
��ۼ������ܽ⣬������Ӧ2LiAlSi2O6+4H2SO4=Li2SO4+Al2(SO4)3+4H2SiO3����Fe2O3+3H2SO4=Fe2(SO4)3+3H2O�����˺�õ���Һ1������Һ1����Ҫ�ɷ�Ϊ��������������������ﮣ�����Һ1�м���̼���Ƶ�����ҺpH��ʹ�����������������������������������ij�����ʽ���������˺�õ���Һ2����Һ2����Ҫ�ɷ�Ϊ����ﮣ�����̼���ƺ�Ӧ�õ�̼��﮳�����̼��﮾���Ӧ����LiCl���ö��Ե缫������ڵ�LiCl���õ�����Li������Li�پ���Ӧ�õ�������ﮣ��ݴ˷������
(1)LiAlSi2O6�����ᷴӦ��������ﮡ��������Ͳ�����ˮ�Ĺ��ᣬ��ѧ����ʽΪ2LiAlSi2O6+4H2SO4=Li2SO4+Al2(SO4)3+4H2SiO3������Һ1�м�̼���Ƶ���pH�������ͼ��֪��Ŀ����Ϊ����������Ԫ������������������������ʽ��ȥ��������2����Ҫ�ɷ�ΪFe(OH)3��Al(OH)3��Ϊ�˾�����ȥ���ʣ���ϱ������ݣ�Ӧ��pH����6.5��ʹFe(OH)3��Al(OH)3��ȫ������
(2)��ϱ�����Ϣ��֪��Li2CO3����ˮ���ܽ�����¶����߶����ͣ�����Ũ������ȹ��ˣ��ܼ���Li2CO3���ܽ���ʧ��Ksp(Li2CO3)=c2(Li+)c(CO32-)=0.202![]() 0.10=4.0��10-3��
0.10=4.0��10-3��
(3)��������LiC1�Ʊ�����Li��������������õ������ɽ���ﮣ�Ϊ��ֹ���������ӵõ��ӣ����������Pt�ȶ��Ե缫�����ڵ�LiCl��
(4)��LiAlH4��ˮ��Ӧ����������ﮡ�������������������ѧ����ʽΪLiAlH4+4H2O=LiOH+Al(OH)3+4H2����
�ڸ��ݷ�Ӧ����ʽ��֪n(H2)=4n(LiAlH4)��������������������ʵ���n(H2)= ![]() ����n(LiAlH4)=
����n(LiAlH4)= ![]() ��m(LiAlH4)=
��m(LiAlH4)= ![]() ������Ϊ
������Ϊ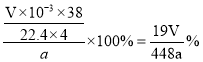



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪Ka(CH3COOH)=1.7��10-5��Kb(NH3��H2O)=1.7��10-5�������£���0.01mol��L-1��ˮ�ζ�20mLŨ�Ⱦ�Ϊ0.01mol��L-1��HCl��CH3COOH�����Һ����Ե�����������백ˮ����仯������ͼ��ʾ�����������������( )
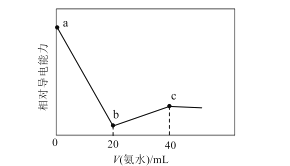
A.a��Ļ����Һ��c(CH3COO-)ԼΪ1.7��10-5mol��L-1
B.b��Ļ����Һ�У�c(CH3COOH)��c(NH4+)
C.c��Ļ����Һ�У�c(NH4+)+c(NH3��H2O)=c(Cl-)+c(CH3COO-)+c(CH3COOH)
D.�����ҺpH=7ʱ�����백ˮ�������40mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ���ǣ� ��
A.56gN2��CO�Ļ������ԭ��������4NA
B.0.1mol/L��������Һ�к�H+����ĿΪ0.2 NA
C.3mol����Fe��ȫȼ��ת��ΪFe3O4��Fe�õ�8NA������
D.��״���£�22.4L SO3��������ԭ����ĿΪ3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ�����֪ʶ��Ȩ������ú���Ҵ���ҵ����Ŀ���������̣�����ú�Ƶ�����������ٽ��������ת��Ϊ�Ҵ����������ת��Ϊ�Ҵ��漰��Ӧԭ����
����Ӧ��CH3COOCH3(g)��2H2(g)![]() C2H5OH(g)��CH3OH(g) ��H1=-23.61kJmol-1
C2H5OH(g)��CH3OH(g) ��H1=-23.61kJmol-1
����Ӧ��CH3COOCH3(g)��C2H5OH(g)![]() CH3COOC2H5(g)��CH3OH(g) ��H2=0.99kJmol-1
CH3COOC2H5(g)��CH3OH(g) ��H2=0.99kJmol-1
�ڴ��������µķ�Ӧ����Ϊ��*��ʾ����̬��
��ѧ������H2��2H*
���淴Ӧ��CH3COOCH3+4H*��CH3CH2OH*+CH3OH*
��ѧ�Ѹ���CH3CH2OH*��CH3CH2OHCH3OH*��CH3OH
��֪����ѧ�����Ļ�ܴ�������Ӧ�ķ�Ӧ���ʡ�
��1��2CH3COOCH3(g)��2H2(g)![]() CH3COOC2H5(g)��2CH3OH(g) ��H3����H3=___��
CH3COOC2H5(g)��2CH3OH(g) ��H3����H3=___��
��2���������������������C2H5OHƽ����ʵ���___��
A.���� B.���� C.��ѹ D.��ѹ E.����
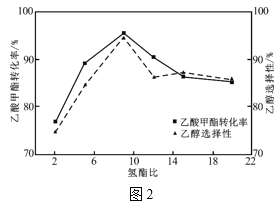
��3����1L�ܱ������г���1mol������������������ƽ��ת�������¶Ⱥ�������(x)[x=![]() ]�Ĺ�ϵ��ͼ1��
]�Ĺ�ϵ��ͼ1��
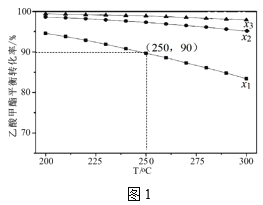
��x1��x2��x3�Ĵ�С��ϵΪ___��
��250�桢x1=10��C2H5OH��ѡ����Ϊ60%��������Ӧ��ƽ�ⳣ��Ϊ___(����2λ��Ч���֣��������Ҵ�ѡ����=![]() ��
��
��4������������ͬ����Ӧ������ͬʱ�䣬���������ת�������Ҵ���ѡ�����������ȵĹ�ϵ��ͼ2��ʾ��������(x)��2~9֮�䣬�Ҵ���ѡ�����������ԭ��Ϊ___��
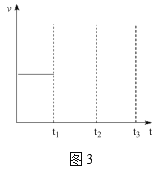
��5��������������Ӧ���ں�ѹ�����£��������������������2molһ��ʱ����ƽ�⣬����t1ʱ���ٳ����1mol�ķ�Ӧ������������䣩��t2ʱ���´ﵽƽ�⣬����ͼ3�л���t1~t3�����淴Ӧ���ʱ仯��ʾ��ͼ��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�ⶨ���Ȼ�һ���就���ܣ�[Co(NH3)5Cl]Cl2��Ħ��������M��ʾ����Ʒ�Ĵ��ȣ���mg��Ʒ��Ϊ10�ȷݣ�ȡ����һ����ǿ����Һ�У�������У��������а�������V1mLc1molL1ϡ���������գ����պ����Һ��c2molL1NaOH�кͣ�ƽ������NaOH��Һ�����ΪV2mL��
��1������Ʒ��[Co(NH3)5Cl]Cl2�Ĵ���Ϊ___��
��2��д����Ҫ������̣�___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʵ����ѡ���װ�û��������г�װ������ȥ�����ܴﵽʵ��Ŀ�ĵ��ǣ� ��
A.����ͼװ���Ʊ����ռ���������
B.����ͼװ��̽��SO2�������Ժ�Ư����
C.����ͼװ���ռ�����������β������
D.����ͼװ�ôӱ����屽�Ļ����Һ�з�����屽
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(SrSO4)��ˮ�еij����ܽ�ƽ���������¡�����˵����ȷ���ǣ� ��
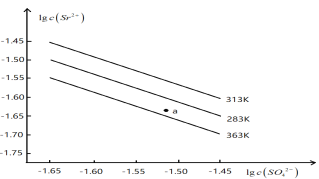
A. �¶�һ��ʱ�� Ksp(SrSO4)��c(SO42��)���������С
B. ������ͬ�¶��У�313 KʱKsp(SrSO4)���
C. 363 Kʱ��ͼ��a���Ӧ����Һ�Dz�������Һ
D. 283K�µ�SrSO4������Һ���µ�363K���Ϊ��������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����������(FexO)1.52 g�������������У���������Һ��ͨ���״����112 mL Cl2��ǡ�ý�Fe2+��ȫ����������˵����ȷ����(����)
A. FexO�������������ֻ������FeCl3��H2O
B. ��״����112 mL Cl2�����ʵ�����5 mol
C. x=0.8
D. ͨ��Cl2������Ӧ�����ӷ���ʽ��Fe2++Cl2![]() Fe3++2Cl��
Fe3++2Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���Ľṹ��ʽ��ͼ������˵������ȷ����
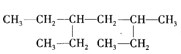
A.���л������ڱ�������
B.������������2��4-���һ�����
C.������2��5-����-3-�һ����黥Ϊͬ���칹��
D.������һ�ȴ��ﹲ��8��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com