
【题目】为测定二氯化一氯五氨合钴([Co(NH3)5Cl]Cl2,摩尔质量用M表示)样品的纯度,将mg样品分为10等份,取其中一份于强碱溶液中,加热煮沸,蒸出所有氨气,用V1mLc1molL1稀硫酸充分吸收,吸收后的溶液用c2molL1NaOH中和,平均消耗NaOH溶液的体积为V2mL。
(1)该样品中[Co(NH3)5Cl]Cl2的纯度为___;
(2)写出简要计算过程:___。
【答案】![]() %或
%或![]() %或
%或![]() %或
%或![]() %
%  ×100%=
×100%=![]() %
%
【解析】
根据题干信息,用V1mLc1molL1稀硫酸充分吸收蒸出的氨气,发生反应2NH3+H2SO4=(NH4)2SO4,吸收后用c2molL1NaOH中和剩余的H2SO4,发生反应H2SO4+2NaOH=Na2SO4+2H2O,平均消耗NaOH溶液的体积为V2mL,则NH3消耗的H2SO4的物质的量为(V1c1×10-3-0.5V2c2×10-3)mol,n(NH3)=2n(H2SO4)=2(V1c1×10-3-0.5V2c2×10-3)mol,根据N原子守恒可得n([Co(NH3)5Cl]Cl2)=![]() n(NH3)=0.4(V1c1×10-3-0.5V2c2×10-3)mol,因此m([Co(NH3)5Cl]Cl2)=0.4M(V1c1×10-3-0.5V2c2×10-3)g,则该样品中[Co(NH3)5Cl]Cl2的纯度为
n(NH3)=0.4(V1c1×10-3-0.5V2c2×10-3)mol,因此m([Co(NH3)5Cl]Cl2)=0.4M(V1c1×10-3-0.5V2c2×10-3)g,则该样品中[Co(NH3)5Cl]Cl2的纯度为![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A.36 g H2O的物质的量为1 mol
B.常温常压下,1mol Cl2的体积是22.4 L
C.0.5mol·L-1NaCl溶液中含有0.5mol Na+
D.1molCO2中含有的分子数约为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置不能达到实验目的的是
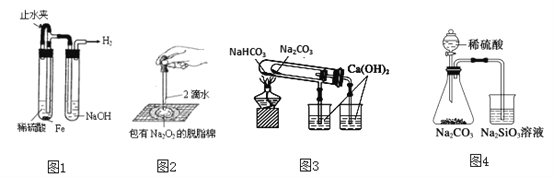
A. 图1:制备并观察氢氧化亚铁
B. 图2:证明过氧化钠与水反应放热
C. 图3:验证NaHCO3和Na2CO3的热稳定性
D. 图4:验证酸性强弱H2SO4>H2CO3>H2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生活密切相关。请按要求回答下列问题:
(1)K2FeO4是一种重要的净水剂,可用下列方法制得:2Fe(OH)3 +3Cl2 +10KOH![]() 2K2FeO4+6KCl+8H2O。在该反应中,还原剂是_____,当反应中有0.5mol K2FeO4生成时,消耗Cl2在标况下的体积为_________,转移电子的数目为_____。
2K2FeO4+6KCl+8H2O。在该反应中,还原剂是_____,当反应中有0.5mol K2FeO4生成时,消耗Cl2在标况下的体积为_________,转移电子的数目为_____。
(2)宇航员常用过氧化钠作供氧剂,写出过氧化钠与二氧化碳反应的化学方程式__________。
(3)厨房里小苏打常作面包和糕点的发泡剂,写出小苏打溶于水的电离方程式:___________。
(4)工业上制漂白粉的化学方程式为_______________________________,新制氯水在阳光照射下产生无色气体,该反应的化学方程式是______。
(5)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出FeCl3溶液与铜发生反应的离子方程式:_____________________。若向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是________。
A.有铜无铁 B.有铁无铜 C.铁、铜都有 D.铁、铜都无
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)比较给出H+的能力的相对强弱:H2CO3___C6H5OH(填“>”、“<”或“=”);用一个离子方程式说明CO32和C6H5O结合H+能力的相对强弱___。
(2)Ca(CN)2是离子化合物,各原子均满足8电子稳定结构。写出Ca(CN)2的电子式___。
(3)常压下,水晶的硬度比晶体硅的硬度大,其主要原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氢铝锂(LiAlH4)常作为有机合成的重要还原剂。工业上以辉锂矿(主要成分是LiAlSi2O6,含少量Fe2O3)为原料合成四氢铝锂的流程如图:
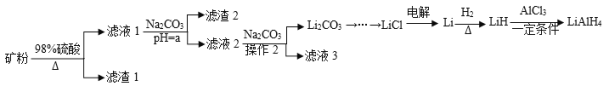
已知:金属氢氧化物沉淀的pH如下表所示:
物质 | Fe(OH)3 | Al(OH)3 |
开始沉淀的pH | 2.3 | 4 |
完全沉淀的pH | 3.7 | 6.5 |
请回答:
(1)写出LiAlSi2O6与硫酸反应的化学方程式__。滤渣2的主要成分为__(填化学式),“a”的最小值为__。
(2)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系如下表所示。操作2中,蒸发浓缩后必须趁热过滤,其原因是__,90℃时Ksp(Li2CO3)的值为__。
温度/℃ | 10 | 30 | 60 | 90 |
浓度/mol·L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
(3)流程中由LiC1制备金属Li的电解条件是__。
(4)为测定制备的四氢铝锂(LiAlH4)的纯度,称取样品ag加入水使其完全反应后,收集到标况下气体VmL,
①LiAlH4溶解时发生反应的化学方程式为__。
②样品的纯度为__(列出数学表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.0molPCl3和1.0molCl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)PCl5(g)达平衡时,PCl5为0.4mol,如果此时移走1.0molPCl3和0.50molCl2,在相同温度下再达平衡时PCl5的物质的量是( )
A. 0.4mol
B. 0.2mol
C. 小于0.2mol
D. 大于0.2mol,小于0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置是实验室制取氨气的装置图,请回答下列问题:
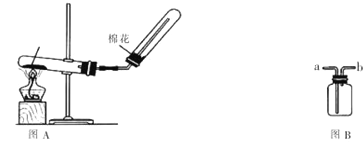
①写出实验室制取氨气的化学方程式_______________________________;
②如果实验室采用图B来收集,则氨气应从______端进。(填“a”或“b”)
③下列干燥剂能用来干燥氨气的是________;
A.碱石灰 B.浓硫酸 C.氯化钙固体
④图A收集氨气的装置中棉花的作用是_______________________________;
⑤有图A收集时,确定氨气是否收满的检验方法是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生命活动密切相关。以下是人体中血红蛋白、肌红蛋白与O2结合机制的相关研究,假定其环境温度均为36.8℃。
(1)血红蛋白Hb结合O2形成动脉血,存在反应①:HbH+(aq)+O2(g)![]() HbO2(aq)+H+(aq)。该反应可自发进行,则其ΔH______0(填“>”或“<”);血液中还同时存在反应②:CO2+H2O
HbO2(aq)+H+(aq)。该反应可自发进行,则其ΔH______0(填“>”或“<”);血液中还同时存在反应②:CO2+H2O![]() H++HCO3-,结合反应①②,肺部氧分压_____(填“较高”或“较低”)有利于CO2排出体外,从化学平衡角度解释原因 ____________。
H++HCO3-,结合反应①②,肺部氧分压_____(填“较高”或“较低”)有利于CO2排出体外,从化学平衡角度解释原因 ____________。
(2)肌肉中大量肌红蛋白 Mb也可结合O2形成MbO2,即反应③:Mb(aq)+O2(g)![]() MbO2(aq),其平衡常数K=
MbO2(aq),其平衡常数K=![]() 。其它条件不变,随着氧分压p(O2)增大,K值___(填“变大”、“变小”或“不变”)。已知在氧分压p(O2)=2.00 kPa 的平衡体系中,
。其它条件不变,随着氧分压p(O2)增大,K值___(填“变大”、“变小”或“不变”)。已知在氧分压p(O2)=2.00 kPa 的平衡体系中, =4.0。吸入的空气中p(O2)=21 kPa,计算此时 Mb与氧气的最大结合度(平衡转化率)约为_______________(保留两位有效数字)。
=4.0。吸入的空气中p(O2)=21 kPa,计算此时 Mb与氧气的最大结合度(平衡转化率)约为_______________(保留两位有效数字)。
(3)Hb分子具有四个亚基,且每个亚基有两种构型(T型和R型)。图中,T0、R0表示未结合O2的T型和R型,且存在可逆的变构效应:T0![]() R0,正向平衡常数为K0;当四分子O2与Hb的四个亚基结合后,T4
R0,正向平衡常数为K0;当四分子O2与Hb的四个亚基结合后,T4![]() R4也是变构效应,正向平衡常数为K4。
R4也是变构效应,正向平衡常数为K4。

①已知某肺炎病人肺脏中T0+4O2![]() T4反应的n(O2)数据如下:
T4反应的n(O2)数据如下:
t/min | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
n(O2)/10-6 mol | 1.68 | 1.64 | 1.58 | 1.50 | 1.40 |
计算2.0 min~8.0 min内以T的物质的量变化表示的反应速率v(T4)为_________mol·min-1。
②现假定R型Hb对O2的结合常数为KR,T型Hb对O2的结合常数为KT。已知KR>KT,则图中K0____K4(填“>”或“<”)。
(4)氧气是生命活动必不可少的物质。如下图所示,以Pt为阳极,Pb(CO2)的载体,使CO2活化为阴极,电解经CO2饱和处理的KHCO3溶液可使氧气再生,同时得到甲醇。其阴极反应式为____;从电解后溶液中分离甲醇的操作方法是_______________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com