
【题目】部分弱酸的电离常数如下表:
弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
电离常数 (25℃) |
|
|
|
|
(1)同温同物质的量浓度的HCOONa(aq)与NaClO(aq)中pH大的是________。
(2)1molCl2与2molNa2CO3(aq)反应除生成NaCl外还有_______________(填化学式)。
(3)向一定量的NaHCO3(aq)中通入少量的SO2(g),反应的离子方程式为__________。亚硒酸(H2SeO3)也是一种二元弱酸,常温下是一种无色固体,易溶于水,有较强的氧化性。
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】甲学生用如1图所示装置证明溴和苯的反应是取代反应而不是加成反应,主要实验步骤如下:
(1)检查装置的气密性,然后向烧瓶中加入一定量的苯和液溴。
(2)向锥形瓶中加入适量某液体,小试管中加入CCl4,并将右边的长导管口浸入CCl4液面下。
(3)将A装置中的纯铁丝小心向下插入混合液中。

请填写下列空白:
①根据课本所学知识:苯是平面型分子(所有原子共平面),甲烷是正四面体型分子,由此推测![]() 中最多______个原子共平面。
中最多______个原子共平面。
②装置B的锥形瓶中小试管内CCl4的作用是_______;小试管外的液体是________。
③反应后,向锥形瓶B中滴加______,现象是___________________。
④乙同学使用图2装置,a中加入一定量的苯,液溴,铁屑,d中液体仍与图1B中小试管外液体相同,后续操作仍然为③,用此装置证明溴和苯的反应是取代反应而不是加成反应,甲认为乙同学的实验不严密,试说明不严密的理由______________。
⑤写出苯与液溴反应的化学方程式____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,向含有![]() 、
、![]() 的200 mL溶液中加入NaOH固体时,溶液中
的200 mL溶液中加入NaOH固体时,溶液中![]() 、
、![]() 随pH的变化曲线如图所示(忽略加人固体时溶液体积的变化)。下列叙述不正确的是( )
随pH的变化曲线如图所示(忽略加人固体时溶液体积的变化)。下列叙述不正确的是( )
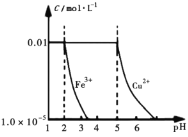
A.![]()
B.![]() 时溶液中的阳离子主要为
时溶液中的阳离子主要为![]() 和
和![]()
C.向含有![]() 杂质的
杂质的![]() 溶液中加入CuO或
溶液中加入CuO或![]() 可除去溶液中混有的
可除去溶液中混有的![]()
D.当加入0.03 mol NaOH时,![]() 、
、![]() 完全沉淀
完全沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产苯乙烯是利用乙苯的脱氢反应如下,针对上述反应,在其它条件不变时,下列说法正确的是( )

A. 加入适当催化剂,可以提高苯乙烯的产量
B. 在保持体积一定的条件下,充入较多的乙苯,可以提高乙苯的转化率
C. 仅从平衡移动的角度分析,工业生产苯乙烯选择恒压条件优于恒容条件
D. 加入乙苯至反应达到平衡过程中,混合气体的平均相对分子质量不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图1所示(加热、搅拌和仪器固定装置均已略去):实验过程如下:

①将1:1的淀粉水乳液与少许硫酸(98%)加入烧杯中,水浴加热至85℃~90℃,保持30min,然后逐渐将温度降至60℃左右;
②将一定量的淀粉水解液加入三颈烧瓶中;
③控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2:1.5)溶液;
④反应3h左右,冷却,减压过滤后再重结晶得草酸晶体,硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
请回答下列问题:
(1)实验①加入98%硫酸少许的作用是:_________;
(2)实验中若混酸滴加过快,将导致草酸产量下降,其原因是_________;
(3)检验淀粉是否水解完全所用的试剂为_________;
(4)草酸重结晶的减压过滤操作中,除烧杯、玻璃棒外,还必须使用属于硅酸盐材料的仪器有_________;
(5)将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸.用KMnO4标准溶液滴定,该反应的离子方程式为:2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O称取该样品0.12g,加适量水完全溶解,然后用0.020molL﹣1的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时溶液颜色变化为_________,滴定前后滴定管中的液面读数如图2所示,则该草酸晶体样品中二水合草酸的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H是一种氨基酸,其合成路线如下:

已知:
①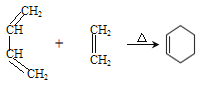
②RMgBr RCH2CH2OH+
RCH2CH2OH+![]()
③R-CHO![]()
![]()
![]()
![]()
完成下列填空:
(1)A的分子式为C3H4O,其结构简式为____________。
(2)E→F的化学方程式为____________。
(3)H的结构简式为_________________。写出满足下列条件的苯丙氨酸同分异构体的结构简______________、________________。
I.含有苯环;II.分子中有三种不同环境的氢原子。
(4)结合题中相关信息,设计一条由CH2Cl2和环氧乙烷(![]() )制备1,4-戊二烯的合成路线(无机试剂任选)。___________。(合成路线常用的表示方式为:A
)制备1,4-戊二烯的合成路线(无机试剂任选)。___________。(合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A. 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl-
B. ![]() =1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
=1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
C. 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42-
D. 水电离的c(H+)=1×10-13mol·L-1的溶液中:K+、Na+、AlO2-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5.6gFe投入浓硝酸中,产生红棕色气体A,把所得溶液减压蒸干,得到20gFe(NO3)2和Fe(NO3)3的混合物,将该固体在高温下加热,得到红棕色的Fe2O3和气体B,A、B气体混合通入足量水中,在标准状况下剩余气体的体积为
A.1120mLB.2240mLC.3360mLD.4480mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究SO2和氯水的漂白性,设计了如下实验,装置如图.完成下列填空:
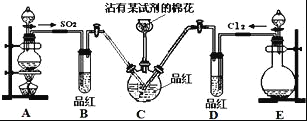
(1)棉花上沾有的试剂是NaOH溶液,作用是______.
(2)①反应开始一段时间后,B、D两个试管中可以观察到的现象分别是:B:_____,D:____.
②停止通气后,分别加热B、D两个试管,可以观察到的现象分别是:B:_____,D:____.
(3)有同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强,他将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不理想.产生该现象的原因(用化学方程式表示)______.
(4)装置E中用_____(填化学式)和浓盐酸反应制得Cl2,生成2.24L(标准状况)的Cl2,则被氧化的HCl为____mol.
(5)实验结束后,检验蘸有试剂的棉花含有SO42﹣的实验方案是:取棉花中的液体少许,滴加足量的稀HNO3,再加入几滴BaCl2溶液,出现白色沉淀.该方案是否合理____,理由是___.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com