
【题目】计算机芯片是一种用硅材料制成的薄片,其大小仅有手指甲的一半。一个芯片是由几百个微电路连接在一起的,体积很小,在芯片上布满了产生脉冲电流的微电路。计算机芯片利用这些微电流,就能够完成控制计算机、计算机自动化装置和其它各种设备所需要的操作。高纯硅是制备半导体材料的重要物质,工业上制备纯硅的方程式为:①![]() ②
②![]() ③
③![]() ;
;
![]() 的反应属于( )
的反应属于( )
A.置换反应B.化合反应C.分解反应D.复分解反应
科目:高中化学 来源: 题型:
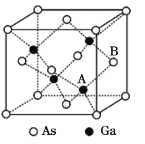
【题目】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)基态Ga原子的核外电子排布式为[Ar]____。
(2)根据元素周期律,元素的电负性Ga____(填“大于”或“小于”,下同)As,第一电离能B____Ga;BF3和NH3的分子能够通过配位键相结合的原因是____。
(3)杀虫剂Na3AsO4中阴离子的空间构型为____,As原子采取____杂化。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是____。
(5)原子晶体GaAs的晶胞参数a=x pm,它的晶胞结构如下图所示。该晶胞内部存在的共价键数为____;该晶体的密度为______g/cm3(阿伏加德罗常数的值用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据信息书写相关反应方程式:
(1)磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。回收废旧磷酸亚铁锂电池正极片[含Al、炭黑、LiFePO4(难溶于水和碱)]中各物质的流程如下图所示:
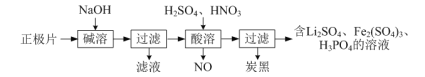
①写出“碱溶”时的离子方程式:________。
②写出“酸溶”时的化学方程式:________。
③LiFePO4可由Fe2O3、碳粉、LiH2PO4在480℃~900℃时混合共热制得,反应中还有CO生成,写出该反应的化学方程式:________。
(2)羟基自由基(电子式为![]() ,本题用·OH表示)有较强的氧化性,常用于污染物的治理。
,本题用·OH表示)有较强的氧化性,常用于污染物的治理。
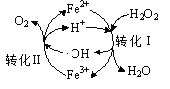
①pH=3时,Fe2+可循环催化H2O2的分解,过程中会产生·OH 中间体,转化过程如右图所示。写出转化Ⅱ的离子方程式:________。
②写出酸性条件下,·OH将水中的乙醛氧化成CO2和H2O的离子方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某蓄电池放电、充电时的反应为:Fe+Ni2O3+3H2O![]() Fe(OH)2+2Ni(OH)2 下列推断中正确的是( )
Fe(OH)2+2Ni(OH)2 下列推断中正确的是( )
放电时,Fe为正极,Ni2O3为负极
②充电时,阴极上的电极反应式是:Fe(OH)2+2e-===Fe+2OH-
③充电时,Ni(OH)2为阳极
④该蓄电池的电极必须是浸在某种碱性电解质溶液中
A.①②③ B.②③④ C.①②④ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)![]() CuS(s)+Mn2+(aq)下列有关叙述中正确的是( )
CuS(s)+Mn2+(aq)下列有关叙述中正确的是( )
①MnS的Ksp大于CuS的Ksp ②达到平衡时c(Mn2+)=c(Cu2+) ③溶液中加入少量Na2S固体后,溶液中c(Cu2+)、c(Mn2+)保持不变 ④该反应平衡常数K=
A. ①④ B. ②③
C. ①②③ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了达到下列的实验要求,请从供选择的化学试剂或实验方法中选出合适的,将其编号填入对应的空格中,并按要求写出相应的方程式。
供选择的化学试剂或实验方法如下:
A.加入NaOH溶液,过滤、洗涤、干燥
![]() 通入适量的
通入适量的![]()
C.通入![]() 气体
气体
![]() 加入适量铁粉
加入适量铁粉
E.加入![]() 溶液,观察
溶液,观察
![]() 加入澄清石灰水,观察
加入澄清石灰水,观察
G.丁达尔效应
(1)鉴别![]() 胶体和
胶体和![]() 溶液:______;
溶液:______;
(2)除去镁粉中的少量铝粉杂质______;
(3)除去![]() 溶液中
溶液中![]() :______,离子方程式______;
:______,离子方程式______;
(4)实验室保存![]() 溶液时要加入______
溶液时要加入______![]()
(5)除去![]() 溶液中的少量
溶液中的少量![]() 杂质:______。
杂质:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某![]() 样品中含有
样品中含有![]() 和
和![]() 杂质,现欲制取纯净的
杂质,现欲制取纯净的![]() ,某同学设计如图的实验方案。请回答下列问题:
,某同学设计如图的实验方案。请回答下列问题:

(1)操作Ⅰ的名称是______,在该操作中用到的玻璃仪器除了有烧杯、玻璃棒,还有______
(2)沉淀A的成分是______![]() 填化学式
填化学式![]() ,写出第③步反应中铝元素转化的离子方程式______
,写出第③步反应中铝元素转化的离子方程式______
(3)写出证明滤液B中![]() 已沉淀完全的实验方法______
已沉淀完全的实验方法______
(4)不改变上述流程图的结构,将“①过量盐酸”“②过量NaOH”交换位置,则“③过量![]() ”应改为_____,写出此方案下生成沉淀B的离子方程式______
”应改为_____,写出此方案下生成沉淀B的离子方程式______
(5)为了得到更加纯净的![]() ,过滤后需要进行操作步骤是______
,过滤后需要进行操作步骤是______
(6)写出工业由氧化铝冶炼铝的化学方程式______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置可验证同主族元素非金属性的变化规律。
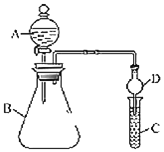
(1)仪器A的名称为______,干燥管D的作用为______。
(2)若要证明非金属性:![]() ,C中为淀粉
,C中为淀粉![]() 碘化钾混合溶液,B中装有
碘化钾混合溶液,B中装有![]() 固体,则A中试剂为______,观察到C中溶液______
固体,则A中试剂为______,观察到C中溶液______![]() 填现象
填现象![]() ,即可证明。从环境保护的观点考虑,此装置缺点______。
,即可证明。从环境保护的观点考虑,此装置缺点______。
(3)若要证明非金属性:![]() ,则在A中______B中加______、C中加______,写出C中反应的化学方程式______
,则在A中______B中加______、C中加______,写出C中反应的化学方程式______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的氯气通入50mL 10.00 mol·L-1的氢氧化钠浓溶液中,加热少许时间后,溶液中只有NaCl、NaClO、NaClO3三种溶质。下列说法正确的是
A.与NaOH反应的氯气物质的量:0.25mol<n(Cl2)<0.5mol
B.若反应中转移的电子为n mol,则0.25<n<0.5
C.溶液中n(Na+):n(Cl-)可能为7:5
D.溶液中n(NaCl):n(NaClO):n(NaClO3)可能为10:2:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com